题目内容
【题目】下图是中学教材中元素周期表的一部分,其中标出A~R 15种元素,试根据它们回答下列问题(填具体元素符号或化学式):
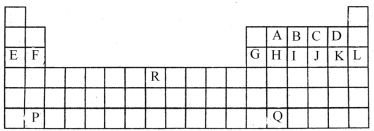
(1)化学性质最不活泼的是____,原子半径最小的是(除稀有气体元素)___属于过渡元素的是____(填A~R中的代号)。
(2)最高价氧化物对应的水化物中酸性最强的是_____,单质中氧化性最强的是________,第三周期元素形成的简单离子中半径最小的是______。
(3)F与K形成的化合物溶于水发生电离,所破坏的化学键为______。
(4)Q在元素周期表中的位置是_____,B、C可形成化合物B2C,该化合物的核外电子总数为_____。
(5)P的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物的离子方程式:____________。
(6)元素E与元素F相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.与酸反应时,每个F原子比每个E原子失电子数多
b.E的氢化物比F的氢化物稳定
c.E和F的单质与水反应E较剧烈
d.最高价氧化物对应水化物碱性E比F强
【答案】Ar F R HClO4 F2 Al3+ 离子键 第六周期ⅣA族 22 H++OH-===H2O Na cd
【解析】
根据元素周期表排布规律分析解答;根据元素周期律的表现分析解答;根据金属性、非金属性强弱判断规律分析解答。
根据元素周期表可知,A为C元素,B为N元素,C为O元素,D为F元素,E为Na元素,F为Mg元素,G为Al元素,H为Si元素,I为P元素,J为S元素,K为Cl元素,L为Ar元素,R为Fe元素,P为Ba元素,Q为Pb元素;
(1)化学性质最不活泼的是稀有气体Ar,原子半径最小的是(除稀有气体元素)第二周期最右边的元素F,其中属于过渡元素的是R即Fe元素,故答案为:Ar,F,R;
(2)非金属性越强,对应的最高价氧化物对应的水化物中酸性越强,元素周期表中非金属性最强的是F其次是O,但是F和O元素无正价,其次为Cl,所以最高价氧化物对应的水化物中酸性最强的是HClO4,非金属性越强,氧化性越强,非金属性最强的是F,其氧化性最强的单质为F2,第三周期中形成的简单离子有2个电子层的有Na+、Mg2+、Al3+,其他元素形成的简单离子均为三个电子层,所以第三周期元素形成的简单离子中半径最小的是两个电子层的Al3+,故答案为:HClO4,F2,Al3+;
(3)F是Mg元素与K是Cl元素形成的化合物MgCl2是离子化合物,仅含有离子键,溶于水发生电离,所破坏的化学键为离子键,故答案为:离子键;
(4)Q是Pb元素,根据元素周期表信息可知,Pb在元素周期表中的位置是第六周期ⅣA族,B为N元素、C为O元素,可形成化合物B2C即N2O,该化合物的核外电子总数为7×2+8=22,故答案为:第六周期ⅣA族,22;
(5)P为Ba元素,Ba的最高价氧化物对应的水化物即Ba(OH)2与B即N元素的最高价氧化物对应的水化物即HNO3反应生成硝酸钡和水,离子方程式为H++OH-===H2O;
(6)元素E为Na与元素F为Mg元素,元素周期表中,同周期元素从左向右金属性逐渐减弱,则金属性Na>Mg,金属性越强,对应的最高价氧化物的水化物的碱性越强,则d正确,金属性越强,则其单质与水或酸反应越剧烈,则c正确;金属性不能用氢化物性质比较,故b错误;金属性与单质与酸反应得失电子数无关,故a错误,故答案为:Na,cd。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案


