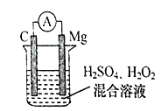
��Ŀ����
����Ŀ��KMnO4����ѧ������ǿ���������ù�������������Ʊ�KMnO4�����̺ͷ�Ӧԭ����ͼ��

��Ӧԭ����
��ӦI��3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
��Ӧ��3K2MnO4+2CO2�T2KMnO4+MnO2��+2K2CO3
��ī��ɫ�� ���Ϻ�ɫ��
��֪25�����ʵ��ܽ��g/100gˮ
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
��ش�
��1�����в�����������ȷ����___
A����Ӧ���ڴ������н��У����ò���������
B����������HCl�������CO2����
C�����ò�����մȡ��Һ����ֽ�ϣ�����ֽ��ֻ���Ϻ�ɫ������ɫ�ۼ�����Ӧ����ȫ
D�������������Ũ������Һ�����о�Ĥ��������ȴ�ᾧ�����ʱ�¶Ȳ��ܹ���
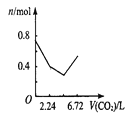
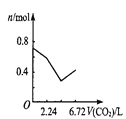
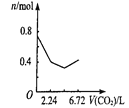
��2��___����������������������ͨ�����CO2���壬������___���û�ѧ����ʽ�ͼ�Ҫ����˵������
��3���������Ӧ�ò�����ά������ֽ���г��˲�����������___��
�����Ƶζ�������������ش��Ȳ������£�
��ȡ1.6000g������ز�Ʒ�����100mL��Һ
��ȷ��ȡ����0.5025g�Ѻ�ɵ�Na2C2O4��������ƿ�У�������������ˮʹ���ܽ⣬�ټ������������ữ��
����ƿ����Һ���ȵ�75��80�棬������I�����Ƶĸ��������Һ�ζ����յ㡣
��¼ʵ���������
ʵ����� | �ζ�ǰ����/mL | �ζ������/mL |
1 | 2.65 | 22.67 |
2 | 2.60 | 23.00 |
3 | 2.58 | 22.56 |
��֪��MnO4��+C2O42��+H+��Mn2++CO2��+H2O��δ��ƽ��
��KMnO4�Ĵ���Ϊ___��������λ��Ч���֣������ζ����Ӷ����������___������ƫ��������ƫ����������Ӱ��������
���𰸡�CD ���� K2CO3+CO2+H2O=2KHCO3 KHCO3�ܽ�ȱ�K2CO3С�ö࣬Ũ��ʱ���KMnO4һ������ 74.06% ƫ��
��������
��ӦI��3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O����Ӧ��3K2MnO4+2CO2�T2KMnO4+MnO2��+2K2CO3���������Һ���ȹ��˵õ���Һ�к���KMnO4��K2CO3������ΪMnO2��
3K2MnO4+KCl+3H2O����Ӧ��3K2MnO4+2CO2�T2KMnO4+MnO2��+2K2CO3���������Һ���ȹ��˵õ���Һ�к���KMnO4��K2CO3������ΪMnO2��
��1��A��KOH����״̬���ܺͶ������跴Ӧ��
B�����������Һ����ǿ�����ԣ����������
C���������Һ����ɫ�����������Һ����ɫ��
D���¶ȹ��ߵ��¸�����طֽ⣻
��2��KHCO3�ܽ�ȱ�K2CO3С�ö࣬Ũ��ʱ���KMnO4һ��������
��3��KMnO4��Һ����ǿ�����ԣ��ḯʴ��ֽ��
���ݵ���غ㡢ת�Ƶ����غ㡢ԭ���غ���ƽ����ʽΪ2MnO4��+5C2O42��+16H��=2Mn2��+10CO2��+8H2O��
1�и��������Һ���=��22.67-2.65��mL=20.02mL��2�и��������Һ���=��23.00-2.60��mL=20.40mL��3�и��������Һ���=��22.56-2.58��mL=20.02mL��2����Һ���ƫ��ϴ���ȥ��ƽ�����������Һ���=20.02mL��n��KMnO4��=![]() n��Na2C2O4��=
n��Na2C2O4��=![]() ��
��![]() =
=![]() ��0.00375mol=0.0015mol���������������=
��0.00375mol=0.0015mol���������������=![]() ��0.1L��158g/mol=1.1838g��
��0.1L��158g/mol=1.1838g��
���ζ����Ӷ�����������Һ���ƫ�͡�
��ӦI��3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O����Ӧ��3K2MnO4+2CO2�T2KMnO4+MnO2��+2K2CO3���������Һ���ȹ��˵õ���Һ�к���KMnO4��K2CO3������ΪMnO2��
3K2MnO4+KCl+3H2O����Ӧ��3K2MnO4+2CO2�T2KMnO4+MnO2��+2K2CO3���������Һ���ȹ��˵õ���Һ�к���KMnO4��K2CO3������ΪMnO2��
��1��A��KOH����״̬���ܺͶ������跴Ӧ�����Բ����ô�������Ӧ��������������A����
B�����������Һ����ǿ�����ԣ����������ᣬ���Բ�����ϡ���ᣬ��B����
C���������Һ����ɫ�����������Һ����ɫ�����Ը�����ɫ�����жϣ���C��ȷ��
D���¶ȹ��ߵ��¸�����طֽ⣬������Ҫ���£���D��ȷ��
��ѡCD��
��2��KHCO3�ܽ�ȱ�K2CO3С�ö࣬Ũ��ʱ���KMnO4һ�������������ķ�ӦΪK2CO3+CO2+H2O=2KHCO3�����Բ���ͨ�����������̼��
��3��KMnO4��Һ����ǿ�����ԣ��ḯʴ��ֽ������Ӧ���ò���ֽ��
���ݵ���غ㡢ת�Ƶ����غ㡢ԭ���غ���ƽ����ʽΪ2MnO4��+5C2O42��+16H+=2Mn2++10CO2��+8H2O��1�и��������Һ���=��22.67��2.65��mL=20.02mL��2�и��������Һ���=��23.00��2.60��mL=20.40mL��3�и��������Һ���=��22.56��2.58��mL=20.02mL��2����Һ���ƫ��ϴ���ȥ��ƽ�����������Һ���=20.02mL��n��KMnO4��=![]() n��Na2C2O4��=
n��Na2C2O4��=![]() ��
��![]() =
=![]() ��0.00375mol=0.0015mol���������������=
��0.00375mol=0.0015mol���������������=![]() ��0.1L��158g/mol=1.1838g���䴿��=
��0.1L��158g/mol=1.1838g���䴿��=![]() ��100%=74.06%��
��100%=74.06%��
���ζ����Ӷ�����������Һ���ƫ�ͣ���ҺŨ��ƫ�ߡ�

����Ŀ����������п��һ�ֶ���Ե����������ϡ�ijС���Դ�����п��������ͭ�������Ϊԭ��ģ�ҵ������������п��������ͼ��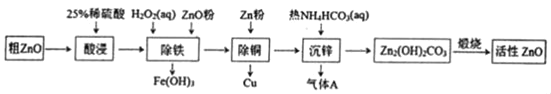
��֪��������������pH��Χ�����ʾ
Zn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
��ʼ���� | 5.4 | 7.0 | 2.3 | 4.7 |
��ȫ���� | 8.0 | 9.0 | 4.1 | 6.7 |
����˵������ȷ���ǣ� ��
A.���������25%ϡ�������98%Ũ�������ƣ��貣�������ձ�������ͷ�ιܵ�����
B.������������ZnO�۵�����ҺpH��4.1��4.7
C.����ͭ���м���Zn�۹������Ʊ���������п�IJ���û��Ӱ��
D.����п����ӦΪ2Zn2++4HCO3���TZn2��OH��2CO3��+3CO2��+H2O