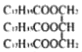题目内容
【题目】芳香族化合物A(C9H11Br)常用于药物及香料的合成,A有如图转化关系(部分反应条件略去):

已知:①A是芳香族化合物且分子侧链上的氢原子只有1种化学环境;
② +CO2
+CO2
(1)I中含氧官能团的名称为___和___。
(2)由A生成B的化学方程式为___。
(3)C→I的反应类型为___。
(4)根据已知信息分析,![]() 在酸性KMnO4溶液作用下所得有机产物的结构简式是___。
在酸性KMnO4溶液作用下所得有机产物的结构简式是___。
(5)写出符合下列条件的G的一种同分异构体的结构简式:___。
①属于芳香族化合物,且核磁共振氢谱有4个峰;
②能发生水解反应和银镜反应,且能与FeCl3溶液发生显色反应
(6)康叉丙酮(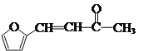 )是一种重要的医药中间体,写出以
)是一种重要的医药中间体,写出以![]() 和
和![]() 为原料制备康叉丙酮的合成路线图___(无机试剂及有机溶剂任用,合成路线图示例见本题题干)。
为原料制备康叉丙酮的合成路线图___(无机试剂及有机溶剂任用,合成路线图示例见本题题干)。
【答案】羟基 羰基 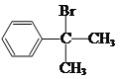 +NaOH
+NaOH![]()
 +NaBr+H2O 加成反应 CH3COCH3
+NaBr+H2O 加成反应 CH3COCH3 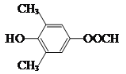 或
或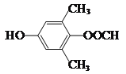
![]()
【解析】
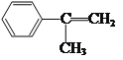
由B的结构简式![]() 结合A的分子式及信息(A是芳香族化合物且分子侧链上的氢原子只有1种化学环境),可逆推出A的结构简式为
结合A的分子式及信息(A是芳香族化合物且分子侧链上的氢原子只有1种化学环境),可逆推出A的结构简式为 ;B 与Br2发生加成反应生成D的结构简式为
;B 与Br2发生加成反应生成D的结构简式为![]() ,水解生成E的结构简式为
,水解生成E的结构简式为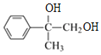 ,氧化生成F的结构简式为
,氧化生成F的结构简式为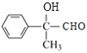 ,再氧化生成G的结构简式为
,再氧化生成G的结构简式为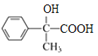 ,发生缩聚反应生成H的结构简式为
,发生缩聚反应生成H的结构简式为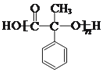 。依此分析进行解题。
。依此分析进行解题。
(1)I的结构简式为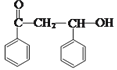 ,分子中含氧官能团的名称为羟基和羰基。答案为:羟基;羰基;
,分子中含氧官能团的名称为羟基和羰基。答案为:羟基;羰基;
(2)由 生成
生成![]() ,则在NaOH的醇溶液中加热,发生卤代烃的消去反应,化学方程式为
,则在NaOH的醇溶液中加热,发生卤代烃的消去反应,化学方程式为 +NaOH
+NaOH![]()
![]() +NaBr+H2O。答案为:
+NaBr+H2O。答案为: +NaOH
+NaOH![]()
![]() +NaBr+H2O;
+NaBr+H2O;
(3)![]() +
+ ![]() →
→ ,反应类型为加成反应。答案为:加成反应;
,反应类型为加成反应。答案为:加成反应;
(4)根据已知信息分析,![]() 在酸性KMnO4溶液作用下,将碳碳双键断开,双键碳原子被氧化为羰基和H2CO3,H2CO3为无机物,所得有机产物的结构简式是
在酸性KMnO4溶液作用下,将碳碳双键断开,双键碳原子被氧化为羰基和H2CO3,H2CO3为无机物,所得有机产物的结构简式是![]() 。答案为:
。答案为:![]() ;
;
(5)符合下列条件:“①属于芳香族化合物,且核磁共振氢谱有4个峰;②能发生水解反应和银镜反应,且能与FeCl3溶液发生显色反应”的有机物,分子内应含有酚羟基、-OOCH、2个连在苯环上且位置对称的-CH3,结构简式为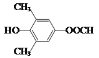 或
或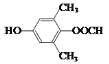 。答案为:
。答案为: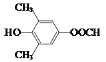 或
或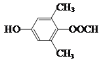 ;
;
(6)由流程图中C→I→J可得出,要合成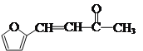 ,需将
,需将![]() 转化为
转化为![]() ,再与
,再与![]() 发生加成反应,产物再发生消去反应。从而得出制备康叉丙酮的合成路线图为
发生加成反应,产物再发生消去反应。从而得出制备康叉丙酮的合成路线图为![]() 。答案为:
。答案为:![]() 。
。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/(kJ/mol) | 351.5 | 463 | 393 | 293 |
则该反应的ΔH=________kJ/mol。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①下列说法不能判断该反应达到化学平衡状态的是________。
A.体系中气体的密度保持不变
B.CO的消耗速率与CH3OH的消耗速率相等
C.体系中CO的转化率和H2的转化率相等
D.体系中CH3OH的体积分数保持不变
②平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
③某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式__________________。
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7/span> |
HI体积分数 | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
①该反应的平衡常数K=_____________。
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线_______________。

【题目】KMnO4是中学常见的强氧化剂,用固体碱熔氧化法制备KMnO4的流程和反应原理如图:

反应原理:
反应I:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知25℃物质的溶解度g/100g水
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
请回答:
(1)下列操作或描述正确的是___
A.反应Ⅰ在瓷坩埚中进行,并用玻璃棒搅拌
B.步骤⑥中可用HCl气体代替CO2气体
C.可用玻璃棒沾取溶液于滤纸上,若滤纸上只有紫红色而无绿色痕迹,则反应Ⅱ完全
D.步骤⑦中蒸发浓缩至溶液表面有晶膜出现再冷却结晶:烘干时温度不能过高
(2)___(填“能”或“不能”)通入过量CO2气体,理由是___(用化学方程式和简要文字说明)。
(3)步骤⑦中应用玻璃纤维代替滤纸进行抽滤操作,理由是___。
草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.6000g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5025g已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。
记录实验数据如表
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 2.65 | 22.67 |
2 | 2.60 | 23.00 |
3 | 2.58 | 22.56 |
已知:MnO4﹣+C2O42﹣+H+→Mn2++CO2↑+H2O(未配平)
则KMnO4的纯度为___(保留四位有效数字);若滴定后俯视读数,结果将___(填“偏高”或“偏低”或“无影响”)。