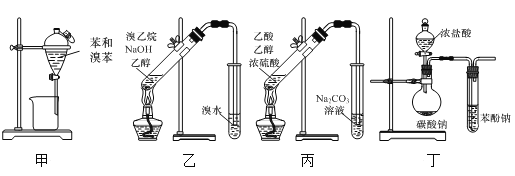
题目内容
【题目】向含有0.2 mol氢氧化钠和0.1 mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72 L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解)
A.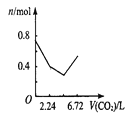 B.
B.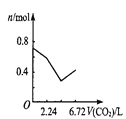 C.
C.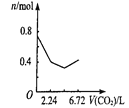 D.
D.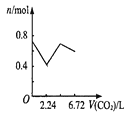
【答案】C
【解析】
n(CO2)=![]() =0.3mol,向含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中通入CO2,二氧化碳首先与氢氧化钙反应2OH-+Ca2++CO2= CaCO3↓+H2O,离子浓度迅速降低,氢氧化钙完全反应,消耗0.1mol CO2,然后二氧化碳与氢氧化钠反应2OH-+CO2=CO32-+H2O,消耗0.1mol CO2,离子浓度继续降低,但幅度减小,最后发生CO2+H2O +CO32-=2HCO3-,离子浓度增大,恰好反应时,0.3mol二氧化碳也完全反应,所以图像C符合,故选C。
=0.3mol,向含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中通入CO2,二氧化碳首先与氢氧化钙反应2OH-+Ca2++CO2= CaCO3↓+H2O,离子浓度迅速降低,氢氧化钙完全反应,消耗0.1mol CO2,然后二氧化碳与氢氧化钠反应2OH-+CO2=CO32-+H2O,消耗0.1mol CO2,离子浓度继续降低,但幅度减小,最后发生CO2+H2O +CO32-=2HCO3-,离子浓度增大,恰好反应时,0.3mol二氧化碳也完全反应,所以图像C符合,故选C。

【题目】KMnO4是中学常见的强氧化剂,用固体碱熔氧化法制备KMnO4的流程和反应原理如图:

反应原理:
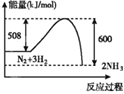
反应I:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知25℃物质的溶解度g/100g水
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
请回答:
(1)下列操作或描述正确的是___
A.反应Ⅰ在瓷坩埚中进行,并用玻璃棒搅拌
B.步骤⑥中可用HCl气体代替CO2气体
C.可用玻璃棒沾取溶液于滤纸上,若滤纸上只有紫红色而无绿色痕迹,则反应Ⅱ完全
D.步骤⑦中蒸发浓缩至溶液表面有晶膜出现再冷却结晶:烘干时温度不能过高
(2)___(填“能”或“不能”)通入过量CO2气体,理由是___(用化学方程式和简要文字说明)。
(3)步骤⑦中应用玻璃纤维代替滤纸进行抽滤操作,理由是___。
草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.6000g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5025g已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。
记录实验数据如表
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 2.65 | 22.67 |
2 | 2.60 | 23.00 |
3 | 2.58 | 22.56 |
已知:MnO4﹣+C2O42﹣+H+→Mn2++CO2↑+H2O(未配平)
则KMnO4的纯度为___(保留四位有效数字);若滴定后俯视读数,结果将___(填“偏高”或“偏低”或“无影响”)。