题目内容
【题目】短周期主族元素Q、X、Y、Z的原子序数逐渐增大,Q的单质是空气的主要成分之一,X与Q同周期,且X是该周期中非金属性最强的元素,Y、Z原子的最外层电子数之和为10,Y与Z形成的某种阴离子的结构如图所示.下列说法正确的是
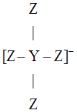
A.X、Z的简单氢化物的水溶液均为强酸
B.Y的单质在常温下性质稳定,不与强酸、强碱反应
C.Y与Z形成的化合物可用作高温结构陶瓷材料
D.简单氢化物的稳定性:Q<X
【答案】D
【解析】
短周期主族元素Q、X、Y、Z 的原子序数依次增大。Q的单质是空气的主要成分之一,则Q为N或O;X与Q同周期且且X是该周期中非金属性最强的元素,则X为F元素;由图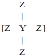 ,Z为-1价阴离子,则Z为Cl元素;Y、Z原子的最外层电子数之和为10,Y最外层电子数为10-7=3,其原子序数大于F,则Y为Al元素,据此解答。
,Z为-1价阴离子,则Z为Cl元素;Y、Z原子的最外层电子数之和为10,Y最外层电子数为10-7=3,其原子序数大于F,则Y为Al元素,据此解答。
A.HF为弱酸,故A错误;
B.Al既能与强酸反应,也能与强碱反应,故B错误;
C.Al与Cl形成的化合物是分子晶体,熔点很低,不可用作高温结构陶瓷材料,故C错误;
D.非金属性N<F或O<F,则简单氢化物的稳定性:Q<X,故D正确;
故选D。

 三新快车金牌周周练系列答案
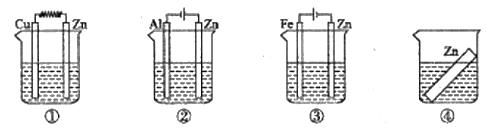
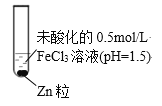
三新快车金牌周周练系列答案【题目】某小组同学为探究Zn与FeCl3溶液的反应,设计并完成了如下实验。
| 实验 | 条件 | 现象 |
ⅰ | 18℃ | 无明显气泡,0.5 min后有气体产生,一段时间后,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 | |
ⅱ | 65℃水浴 | 有气泡产生,12 s后,气泡非常明显,溶液很快转为红棕色,一段时间后,红棕色消失,最后产生红棕色沉淀 |
(1)实验ⅰ和ⅱ中均有气体产生,该气体为 ________。
(2)实验ⅱ中产生气体的速率明显快于实验ⅰ,可能的原因是________。
(3)“加铁氰化钾溶液有蓝色沉淀生成”说明混合溶液中存在________。
(4)实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化。研究小组猜想,可能是此实验条件下,氧化性H+>Fe3+。
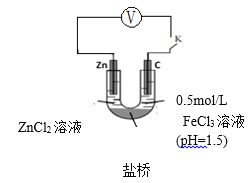
查阅资料:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。根据资料小组同学设计了如下对比实验。
实验ⅲ | 实验ⅳ |
| _____________ |
①请在表格中画出实验ⅳ的装置图 。
②进行对比实验,观察到________,得出氧化性:Fe3+>H+。
研究小组进一步分析后,将Zn粒改为Zn粉,继续进行实验。
实验 | 条件 | 现象 |
ⅴ | 18℃,混合后不振荡 | 3 min后有明显的气泡产生,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
ⅵ | 18℃,混合后振荡 | 气泡不明显,红棕色褪色明显,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
③对比实验ⅴ和ⅵ,解释“气泡不明显,红棕色褪色明显”的可能原因:________。
(5)结合实验探究过程及现象,影响Zn与FeCl3溶液的反应过程的条件有________。