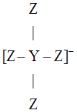题目内容
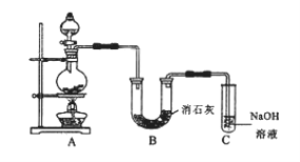
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,试回答:
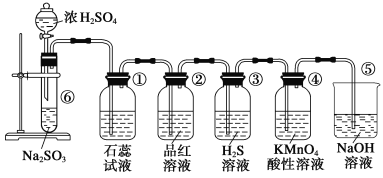
(1)在⑥中发生反应的化学方程式为___________。
(2)②中的品红溶液__________,证明SO2有________性。
(3)④中的实验现象是______,证明SO2有______性。
(4)⑤的作用是________,反应的化学方程式为________。
【答案】Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 红色褪去 漂白性 紫红色褪去 还原性 尾气处理,吸收多余的SO2 ,防止污染空气 2NaOH+SO2=Na2SO3+H2O
【解析】
在试管⑥中亚硫酸钠与浓硫酸反应生成SO2、Na2SO4和水,反应产生的SO2与水作用产生H2SO3,具有酸性,可以使紫色石蕊试液变为红色;SO2具有漂白性,与品红溶液作用生成无色物质,而能使品红溶液褪色;SO2具有氧化性,与H2S在溶液中发生氧化还原反应,产生S单质,使溶液变浑浊,SO2具有还原性,能够被KMnO4氧化而使溶液紫色褪去;SO2是有毒气体,不能直接排放到空气中,可以利用其与碱反应的性质,用氢氧化钠溶液进行尾气处理。
(1)⑥中为亚硫酸钠和浓硫酸反应生成、Na2SO4、SO2、H2O,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2) SO2具有漂白性,与②中的品红作用生成无色物质,能使品红溶液褪色;
(3)SO2具有还原性,能够与④中的KMnO4发生氧化还原反应生成硫酸钾、硫酸锰和硫酸,使KMnO4溶液的紫红色的褪色,SO2表现还原性,KMnO4表现氧化性;
(4)SO2具有有毒,不能直接排放到空气中,由于SO2是酸性氧化物,能够与氢氧化钠反应生成亚硫酸钠和水,所以可以用氢氧化钠溶液吸收二氧化硫,反应的化学方程式为:2NaOH+SO2=Na2SO3+H2O。

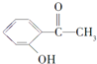
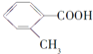
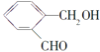
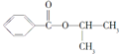
【题目】已知A--F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
化合物 | A | B | C |
结构简式 |
|
|
|
化合物 | D | E | F |
结构简式 |
|
|
|
![]() 写出符合下列条件的A的同分异构体的结构简式: ______ 。
写出符合下列条件的A的同分异构体的结构简式: ______ 。
A.核磁共振氢谱有4组峰
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
![]() 化合物B是制取抗心律失常药物--氟卡尼的中间体,下列有关描述不正确的是______
化合物B是制取抗心律失常药物--氟卡尼的中间体,下列有关描述不正确的是______ ![]() 填字母
填字母![]() 。
。
A.能与氯化铁溶液显色![]() 分子中含有羧基、羟基等官能团
分子中含有羧基、羟基等官能团
C.能与溴水反应![]() 能与碳酸钠溶液反应产生二氧化碳
能与碳酸钠溶液反应产生二氧化碳
![]() 化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为 ______ 。
化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为 ______ 。
![]() 化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去。
化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去。
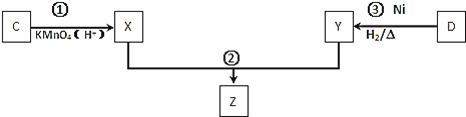
反应![]() 中D与
中D与![]() 按物质的量1:1反应生成Y,则反应
按物质的量1:1反应生成Y,则反应![]() 的化学方程式为 ______ 。
的化学方程式为 ______ 。
![]() 化合物D与银氨溶液反应的化学方程式
化合物D与银氨溶液反应的化学方程式![]() 有机物用结构简式表示
有机物用结构简式表示![]() : ______ 。
: ______ 。
![]() 化合物F是合成克矽平的原料之一,
化合物F是合成克矽平的原料之一,![]() 克矽平是一种治疗矽肺病的药物
克矽平是一种治疗矽肺病的药物![]() ,其合成路线如下
,其合成路线如下![]() 反应均在一定条件下进行
反应均在一定条件下进行![]() :
:

![]() 反应
反应![]() 是原子利用率
是原子利用率![]() 的反应,则该反应的化学方程式为 ______ ;
的反应,则该反应的化学方程式为 ______ ;
![]() 上述转化关系中没有涉及的反应类型是 ______
上述转化关系中没有涉及的反应类型是 ______ ![]() 填代号
填代号![]() 。
。
![]() 加成反应
加成反应![]() 消去反应
消去反应![]() 还原反应
还原反应![]() 氧化反应
氧化反应![]() 加聚反应
加聚反应![]() 取代反应。
取代反应。
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式________________.
(2)B元素在周期表中的位置____________________;离子半径:B________A(填“大于”或“小于”).
(3)C原子的电子排布图是_______________________,其原子核外有___个未成对电子,能量最高的电子为___轨道上的电子,其轨道呈___________形.
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为_______________________________,与D的氢化物的水化物反应的化学方程式为_____________________________.