题目内容
下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有 个,π键有 个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构形为 ,属于 分子(填“极性”或“非极性”)。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
(7)1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。


在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________。
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | | | | |
| | ④ | | | | | | | | | | | ⑤ | | | ⑥ | ⑦ | |
| | ⑧ | | | | | | ⑨ | | | ⑩ | | | | | | | |
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有 个,π键有 个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构形为 ,属于 分子(填“极性”或“非极性”)。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
(7)1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。


在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________。
(每空1分,共,11分)(1)⑨ (2)苯 (3)Cl> S> Mg> Al(4)2,2
(5) 1 ,三角锥形,极性 (6) Be(OH)2+2NaOH=Na2BeO2+2H2O (7)8 , 12
(5) 1 ,三角锥形,极性 (6) Be(OH)2+2NaOH=Na2BeO2+2H2O (7)8 , 12
试题分析:(1)区的名称来自于按照构造原理最后填入电子的轨道名称,属于表中属于d区的元素是⑨。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子是苯。
(3)④ ⑤ ⑥ ⑦四种元素分别是Mg、Al、S、Cl。金属性越强第一电离能越大。但由于镁元素的3s轨道电子处于全充满状态,所以第一电离能对于Al元素的,则第一电离能由大到小的顺序是Cl> S> Mg> Al。
(4)按原子轨道的重叠方式,③与⑥形成的化合物是二硫化碳,分子中含有2个双键。而双键是由1个σ键和1个π键构成的,所以分子中σ键有2个,π键有2个。
(5)某元素的特征电子排布式为nsnnpn+1,则该元素是第ⅤA族元素。所以该元素原子的核外最外层电子的孤对电子数为1;该元素与元素①形成的分子X是氨气,其空间构形为三角锥形结构,属于极性分子。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。由于⑤是铝元素,能氢氧化铝能和氢氧化钠溶液反应生成偏铝酸钠和水,则元素②即Be的氢氧化物与NaOH溶液反应的化学方程式Be(OH)2+2NaOH=Na2BeO2+2H2O。
(7)⑨是铁元素,则根据图1可知,与⑨原子等距离且最近的⑨原子数为8个;在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为12个。
点评:该题是中等难度的试题,试题基础性强,侧重能力的培养。该题考查的知识点比较多,且分散,但都很基础,主要是有利于培养学生灵活运用基础知识解决实际问题的能力,有助于培养学生的应试能力和学习效率。

练习册系列答案
相关题目
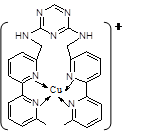

 若
若


 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
