题目内容
【题目】Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉(Cd3(PO4)2)沉淀溶解平衡常数的表达式Ksp=________。
(2)一定温度下,CdCO3的Ksp=4.0 × 10-12,Cd(OH)2的Ksp=3.2 × 10-14,那么它们在水中的溶解量________较大。
(3)在某含镉废水中加人Na2S,当S2-浓度达到7.9 × 10-8mol/L时,水体中Cd2+浓度为_____mol/L(已知:Ksp(CdS)=7.9 × 10-27,Ar(Cd)=112);此时是否符合水源标准?______(填“是”或“否”)。
Ⅱ、炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
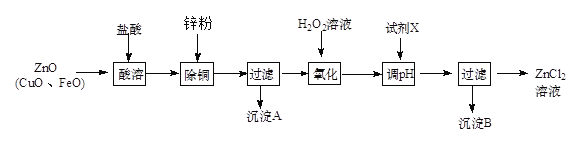
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1. 1 | 5. 2 | 5. 8 |
沉淀完全的pH | 3. 2 | 6. 4 | 8. 8 |
(1)加入H2O2溶液的作用是________________。
(2)流程图中,调节pH时,加入的试剂X可以是________(填序号)
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到_________。
【答案】 c(Cd2+)3·c(PO43-)2 Cd(OH)2 10-19 是 使Fe2+被氧化为Fe3+ AC 3.2≤pH<5.2
【解析】Ⅰ、(1)根据磷酸镉沉淀溶解平衡方程式写出其沉淀溶解平衡常数的表达式;(2)分别根据CdCO3和Cd(OH)2的沉淀溶解平衡表达式计算二者的平衡溶解度,据此比较它们在水中的摩尔溶解度;(3)根据CdS的溶度积常数计算水体中Cd2+的浓度,将体积摩尔浓度转化为质量摩尔浓度再与排放标准做对比,据此分析是否符合标准;
Ⅱ、(1)加过氧化氢把亚铁离子氧化为铁离子;(2)调节pH时要消耗氢离子,但是不能引入杂质;调节pH使铁离子转化为沉淀,而锌离子不沉淀,根据表中数据分析。
Ⅰ、(1)磷酸镉沉淀溶解平衡方程式为:Cd3(PO4)2(s)3Cd2++2PO43-,则其沉淀溶解平衡常数表达式为Ksp=c3(Cd2+)c2(PO43-),故答案为:c3(Cd2+)c2(PO43-);
(2)当CdCO3达到沉淀溶解平衡时有CdCO3(s)Cd2++CO32-,则其平衡时摩尔溶解度为s=![]() =2×10-6mol/L,当Cd(OH)2达到沉淀溶解平衡时有Cd(OH)2(s)Cd2++2OH-,则其平衡时摩尔溶解度为s=
=2×10-6mol/L,当Cd(OH)2达到沉淀溶解平衡时有Cd(OH)2(s)Cd2++2OH-,则其平衡时摩尔溶解度为s=![]() =2×10-5mol/L,因此溶解度更大的是Cd(OH)2,故答案为:Cd(OH)2;
=2×10-5mol/L,因此溶解度更大的是Cd(OH)2,故答案为:Cd(OH)2;
(3)含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mgL-1时,溶液中c(Cd2+)=![]() =1.0×10-19mol/L,即水体系中的Cd2+质量摩尔浓度为1.0×10-19×112×103mg/L=1.12×10-14mg/L<0.005mg/L,因此符合标准,故答案为:1.0×10-19mol/L;是;
=1.0×10-19mol/L,即水体系中的Cd2+质量摩尔浓度为1.0×10-19×112×103mg/L=1.12×10-14mg/L<0.005mg/L,因此符合标准,故答案为:1.0×10-19mol/L;是;
Ⅱ、(1)根据流程分析可知,加过氧化氢的目的是将亚铁离子氧化为铁离子,故答案为:将亚铁离子氧化为铁离子;
(2)调节pH时要消耗氢离子,但是不能引入杂质,ZnO、Zn(OH)2、Zn2(OH)2CO3均与氢离子反应生成锌离子,消耗氢离子的同时不引入杂质,ZnSO4不能与氢离子反应,所以不能调节pH,故选AC,调节pH使铁离子转化为沉淀,而锌离子不沉淀,由表中数据可知pH≥3.2时,铁离子完全沉淀,而锌离子开始沉淀的pH为5.2,所以要调节pH为3.2≤pH<5.2,故答案为:AC;3.2≤pH<5.2。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】下列各组物质,不能按 ![]() (“―→”表示反应一步完成)关系转化的是( )
(“―→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D




