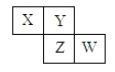题目内容
【题目】某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置。

请回答下列问题:
(1)仪器a的名称为_________;装置A的圆底烧瓶中盛放的固体物质可选用__________(填序号)。
a.氯化钠 b.氢氧化钠 c.碳酸钙
(2)装置F的圆底烧瓶中发生反应的离子方程式为___________;装置E的洗气瓶中盛放的试剂为 ____________。
(3)反应过程中,装置C的集气瓶中有大量白烟产生,另一种产物为空气的主要成分之一,该反应的化学方程式为 _________。
(4)从装置C的b处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有 ________溶液的洗气瓶。
【答案】分液漏斗 b MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 饱和氯化钠溶液 8NH3+3Cl2=N2+6NH4Cl 氢氧化钠
Mn2++Cl2↑+2H2O 饱和氯化钠溶液 8NH3+3Cl2=N2+6NH4Cl 氢氧化钠
【解析】
A装置制备氨气,利用B装置中的碱石灰干燥氨气,F装置制备氯气,E装置除去氯气中的氯化氢,D装置干燥氯气,在C装置中氯气氧化氨气,据此解答。
(1)根据仪器构造可判断仪器a的名称为分液漏斗;a.氯化钠与氨水不反应,不能制备氨气;b.氢氧化钠溶于水放热,且增大氢氧根的浓度,可以和氨水混合制备氨气;c.碳酸钙与氨水不反应,不能制备氨气;答案选b;
(2)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。浓盐酸易挥发,生成的氯气中含有氯化氢,E中装有饱和食盐水,食盐水中含有氯离子,能抑制氯气的溶解,作用为除去氯气中混有的氯化氢;
Mn2++Cl2↑+2H2O。浓盐酸易挥发,生成的氯气中含有氯化氢,E中装有饱和食盐水,食盐水中含有氯离子,能抑制氯气的溶解,作用为除去氯气中混有的氯化氢;
(3)C内出现浓厚的白烟为氯化铵,另一生成物是空气的主要成分之一为氮气,因此该反应的方程式为3Cl2+8NH3=N2+6NH4Cl;
(4)氯气是有毒气体,需要尾气处理,则可将尾气通过盛有氢氧化钠溶液的洗气瓶吸收。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉(Cd3(PO4)2)沉淀溶解平衡常数的表达式Ksp=________。
(2)一定温度下,CdCO3的Ksp=4.0 × 10-12,Cd(OH)2的Ksp=3.2 × 10-14,那么它们在水中的溶解量________较大。
(3)在某含镉废水中加人Na2S,当S2-浓度达到7.9 × 10-8mol/L时,水体中Cd2+浓度为_____mol/L(已知:Ksp(CdS)=7.9 × 10-27,Ar(Cd)=112);此时是否符合水源标准?______(填“是”或“否”)。
Ⅱ、炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
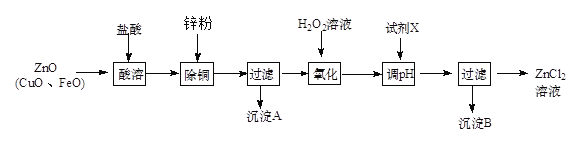
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1. 1 | 5. 2 | 5. 8 |
沉淀完全的pH | 3. 2 | 6. 4 | 8. 8 |
(1)加入H2O2溶液的作用是________________。
(2)流程图中,调节pH时,加入的试剂X可以是________(填序号)
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到_________。