题目内容
【题目】常温下,向10mL bmol·L-1的CH3COOH溶液中滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(Na+)=c(CH3COO-), 下列说法正确的是( )
A. b<0.01
B. 混合后溶液呈碱性
C. 常温下,所得溶液中CH3COOH的的电离常数Ka=![]() mol·L-1
mol·L-1
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
【答案】C
【解析】根据题意知,常温下,向10mLb mol·L-1的CH3COOH溶液中滴加等体积的0.01 mol·L-1的NaOH溶液,充分反应后溶液中c(Na+)=c(CH3COO—),则反应后的溶液为醋酸和醋酸钠的混合液。
反应后溶液为醋酸和醋酸钠的混合液,则醋酸过量,b>0.01,A错误; 反应后溶液为醋酸和醋酸钠的混合液,根据电荷守恒有c(Na+)+c(H+)=c(CH3COO—)+ c(OH—),又c(Na+)=c(CH3COO—),则c(H+)=c(OH—),混合后溶液呈中性,B错误;CH3COOH的电离常数Ka= c(CH3COO—)c(H+)/c(CH3COOH),c(Na+)=c(CH3COO—)=0.005mol·L-1,c(H+)=c(OH—)=10-7mol·L-1,c(CH3COOH)=(b-0.01)/2 mol·L-1,代入计算得![]() ,C正确;向CH3COOH溶液中滴加NaOH溶液的过程中生成强碱弱酸盐醋酸钠,醋酸根水解促进水的电离,水的电离程度逐渐增大,D错误;正确答案C。
,C正确;向CH3COOH溶液中滴加NaOH溶液的过程中生成强碱弱酸盐醋酸钠,醋酸根水解促进水的电离,水的电离程度逐渐增大,D错误;正确答案C。

【题目】Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉(Cd3(PO4)2)沉淀溶解平衡常数的表达式Ksp=________。
(2)一定温度下,CdCO3的Ksp=4.0 × 10-12,Cd(OH)2的Ksp=3.2 × 10-14,那么它们在水中的溶解量________较大。
(3)在某含镉废水中加人Na2S,当S2-浓度达到7.9 × 10-8mol/L时,水体中Cd2+浓度为_____mol/L(已知:Ksp(CdS)=7.9 × 10-27,Ar(Cd)=112);此时是否符合水源标准?______(填“是”或“否”)。
Ⅱ、炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
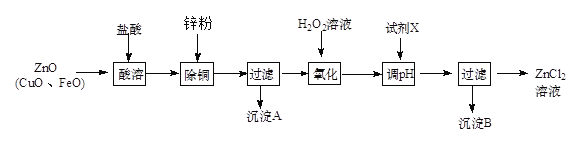
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1. 1 | 5. 2 | 5. 8 |
沉淀完全的pH | 3. 2 | 6. 4 | 8. 8 |
(1)加入H2O2溶液的作用是________________。
(2)流程图中,调节pH时,加入的试剂X可以是________(填序号)
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到_________。