题目内容
3.下列说法正确的是( )| A. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 | |
| B. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| C. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生 | |
| D. | 100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
分析 A.浓硫酸与铁发生钝化反应;
B.加入催化剂或升高温度,可增大活化分子百分数;
C.铜与硝酸反应生成NO;
D.氯化钠不参与反应,但溶液浓度减小.
解答 解:A.浓硫酸具有强氧化性,常温下与铁发生钝化作用,不能增大反应速率,如加热,则生成二氧化硫气体,故A错误;
B.MnO2为反应的催化剂,加入催化剂或升高温度,可增大活化分子百分数,增大反应速率,故B正确;
C.形成原电池反应时,硝酸被还原生成NO,故C错误;
D.氯化钠不参与反应,但溶液浓度减小,则反应速率减小,故D错误.
故选B.
点评 本题综合考查化学反应速率,侧重于影响化学反应速率的因素的考查,为高考高频考点,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
13.250mL K2SO4和CuSO4的混合溶液中c(SO42-)=0.5mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
| A. | 电解得到Cu的质量为3.2 g | |
| B. | 上述电解过程中共转移电子0.2 mol | |
| C. | 电解后的溶液中c(H+)=0.2 mol•L-1 | |
| D. | 原混合溶液中c(K+)=0.6 mol•L-1 |
14.下列有关有机物的说法正确的是( )
| A. | 蛋白质溶液与淀粉溶液可用丁达尔效应鉴别 | |
| B. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 | |
| C. | 实验室只需用乙酸与乙醇共热就可制得乙酸乙酯 | |
| D. | 将葡萄糖加入新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 |
11.六氟化硫(SF6)具有良好的高压绝缘性,在电器工业中有着广泛的用途,SF6分子呈正八面体结构,S 原子位于正八面体的中心.下列关于SF6的推测中,正确的是( )
| A. | SF6在氧气中燃烧可生成SO2 | |
| B. | SF6晶体是原子晶体 | |
| C. | SF6是非极性分子 | |
| D. | SF6中各原子的最外电子层都达到8电子稳定结构 |
8.下列有关化学反应速率和限度的说法中,正确的是( )
| A. | 用H2O2分解制O2,加入1~2滴FeCl3溶液,反应速率加快 | |
| B. | 在金属钠与足量水反应中,增加水的量能加快反应速率 | |
| C. | 一定条件下的反应:2SO2+O2?2SO3中,SO2的转化率能达到100% | |
| D. | 用铁和稀硫酸制取氢气,将稀硫酸换成浓硫酸可以加快反应速率 |
15.下列实验装置或操作能达到实验目的是( )
| A. | 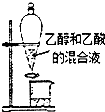 分离乙醇和乙酸 | B. |  制取乙酸乙酯 制取乙酸乙酯 | C. | 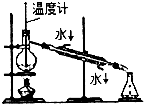 石油的蒸馏 石油的蒸馏 | D. | 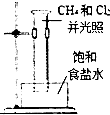 甲烷与氯气反应 |
12.分析原子的杂化方式,并根据等电子体原理判断下列各组分子中的所有原子,或者处于同一平面,或者在一条直线上的是( )
| A. | C2H2、HClO、C2H6 | B. | CO2、N2O、HC≡C-NH2 | ||
| C. | C6H5CH3、C3H4、CH4 | D. | C6H6、C2H4、HCN |