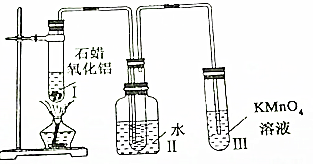
题目内容
11.六氟化硫(SF6)具有良好的高压绝缘性,在电器工业中有着广泛的用途,SF6分子呈正八面体结构,S 原子位于正八面体的中心.下列关于SF6的推测中,正确的是( )| A. | SF6在氧气中燃烧可生成SO2 | |
| B. | SF6晶体是原子晶体 | |
| C. | SF6是非极性分子 | |
| D. | SF6中各原子的最外电子层都达到8电子稳定结构 |
分析 A.SF6中S为+6价,不能和氧气反应生成SO2;
B.由分子构成的晶体是分子晶体,由原子构成的晶体是原子晶体;
C.结构对称、正负电荷重心重合的分子为非极性分子;
D.中心元素价电子数+化合价的绝对值=8时该分子中所有原子都达到8电子稳定结构,但氢化物除外.
解答 解:A.SF6中S为+6价,F元素为-2价,如果能和氧气反应生成SO2,则F元素要得电子,F元素已经达到饱和状态,所以不能再得电子,故A错误;
B.该晶体的构成微粒是分子,所以属于分子晶体,故B错误;
C.结构对称、正负电荷重心重合的分子为非极性分子,SF6分子呈正八面体结构,S 原子位于正八面体的中心,该分子结构对称、正负电荷重心重合,所以为非极性分子,故C正确;
D.中心元素价电子数+化合价的绝对值=8时该分子中所有原子都达到8电子稳定结构,但氢化物除外,该化合物中S元素化合价+价电子数=6+6=12,则S原子不是8电子稳定结构,故D错误;
故选C.
点评 本题考查分子极性判断、晶体类型判断、8电子结构等知识点,侧重考查学生获取信息利用信息能力,知道8电子结构的判断方法,易错选项是A.

练习册系列答案
相关题目
1.下列金属防腐蚀的方法中,使用外加电流的阴极保护法的是( )
| A. | 水中的钢闸门连接电源负极 | B. | 在锅炉内壁装上镁合金 | ||
| C. | 汽车底盘喷涂高分子膜 | D. | 在铁板表面镀锌 |
2.下列叙述中不正确的是( )
| A. | 电解池的阳极上发生氧化反应,阴极上发生还原反应 | |
| B. | 原电池的正极上发生氧化反应,负极上发生还原反应 | |
| C. | 粗铜精炼时,粗铜应与直流电源的正极相连 | |
| D. | 用原电池做电源进行电解时,电子从原电池负极流向电解池阴极 |
6.某小组用如图装置进行实验,下列说法正确的是( )


| A. | 盐桥中的电解质可以用KC1 | |
| B. | 闭合K,外电路电流方向为Fe电极→石墨电极 | |
| C. | 闭合K,石墨电极上只生成铜 | |
| D. | 导线中流过0.15 mol e-时,加入5.55 gCu2(OH)2CO3,CuSO4溶液可恢复原组成 |
16. 中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
 中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )| A. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| D. | 若D是一种强酸且可与铜反应生成B或C,则A既可以是单质也可以是化合物 |
3.下列说法正确的是( )
| A. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 | |
| B. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| C. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生 | |
| D. | 100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
20.下列关于甲烷的说法不正确的是( )
| A. | 是最简单的有机化合物 | |
| B. | 在1500℃以上能比较完全地分解,生成炭黑和氢气 | |
| C. | 与等物质的量的氯气混合在光照下充分反应,生成物中HC1的物质的量最大 | |
| D. | 完全燃烧生成的CO2和H2O的物质的量之比是1:1 |
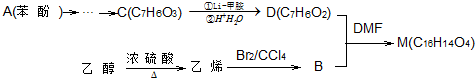
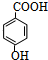 .
. .
. .
.