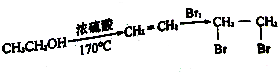题目内容
13.H2SO4溶液与1mol Fe反应,得到的气体的物质的量是多少?在标况下的体积是多少?分析 发生反应:Fe+H2SO4=FeSO4+H2↑,根据方程式计算氢气的物质的量,再根据V=nVm计算氢气的体积.
解答 解:设生成氢气的物质的量为x,则:
Fe+H2SO4=FeSO4+H2↑
1mol 1mol
1mol x
故x=$\frac{1mol×1mol}{1mol}$=1mol,
标况下生成氢气体积为1mol×22.4L/mol=22.4L,
答:生成氢气为1mol,标况下其体积为22.4L.
点评 本题考查化学方程式计算,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
3.下列说法正确的是( )
| A. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 | |
| B. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| C. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生 | |
| D. | 100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
4.下列物质中,属于碱的是( )
| A. | 苛性钠 | B. | 纯碱 | C. | 碱式碳酸铜 | D. | 碱石灰 |
8.下列有关化学用语表示正确的是( )
| A. | ${\;}_{8}^{18}$O2-离子结构示意图: | B. | 四氯化碳分子的比例模型: | ||
| C. | 次氯酸的电子式: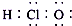 | D. | 中子数为16的硫离子:${\;}_{16}^{32}$S2- |
7.X、Y、Z、W、R是原子序数依次增大的四种短周期元素,W的焰色反应呈黄色,X、W是同主族元素,可形成离子化合物WX,R与Z属于同一主族,Y、Z两种元素形成化合物是光化学污染的魁首,下列说法不正确的是( )
| A. | 原子半径:W>R>Y>Z>X | |
| B. | X、Y和Z三种元素形成化合物中一定含有离子键和共价键 | |
| C. | 气态氢化物的稳定性:Z>Y>R | |
| D. | Y的最高价氧化物对应的水化物一定有强的氧化性 |
8.下列说法不正确的是( )
| A. | 鉴别乙醇、四氯化碳和苯可以用蒸馏水 | |
| B. | 鉴别羊毛织物和棉织物可以用灼烧并闻气味的方法 | |
| C. | 除去乙酸乙酯中含有的乙酸,最好的方法是蒸馏 | |
| D. | 鉴别甲烷、一氧化碳和氢气的方法是:点燃并先后罩上干燥的冷烧杯和涂有澄清石灰水的烧杯 |
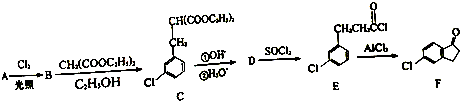
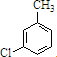 ,反应D→E的反应类型取代反应.
,反应D→E的反应类型取代反应.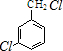 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$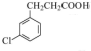 ,某化学物是D的同分异构体,能使FeCl3溶液显紫色,且分子中只有3种不同化学环境的氢,写出该化合物的结构简式:
,某化学物是D的同分异构体,能使FeCl3溶液显紫色,且分子中只有3种不同化学环境的氢,写出该化合物的结构简式: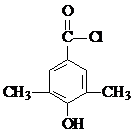 或
或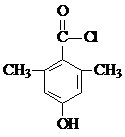 (任写一种).
(任写一种). .
.