题目内容
13.250mL K2SO4和CuSO4的混合溶液中c(SO42-)=0.5mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )| A. | 电解得到Cu的质量为3.2 g | |
| B. | 上述电解过程中共转移电子0.2 mol | |
| C. | 电解后的溶液中c(H+)=0.2 mol•L-1 | |
| D. | 原混合溶液中c(K+)=0.6 mol•L-1 |
分析 石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12L气体(标准状况),
则阴极发生反应为:Cu2++2e-═Cu、2H++2e-═H2↑,
阳极发生反应为:4OH--4e-═O2↑+2H2O,
n(O2)=n(H2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,结合电子守恒及物质的量浓度的计算来解答.
解答 解:石墨作电极电解此溶液,当通电一段时间后,两极均收集1.12L气体(标准状况),n(O2)=n(H2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
阳极发生 4OH--4e-═O2↑+2H2O,
0.2mol 0.05mol
阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
0.05mol 0.1mol 0.1mol 0.1mol 0.1mol 0.05mol
A.电解得到的Cu的物质的量为0.05mol,质量为:64g/mol×0.05mol=3.2g,故A正确;
B.由上述分析可知,电解过程中转移电子总数为:0.05mol×4=0.2mol,故B正确;
C.电解后溶液中氢离子的物质的量浓度为:c(H+)=$\frac{0.2mol-0.1mol}{0.25L}$=0.4mol/L,故C错误;
D.c(Cu2+)=$\frac{0.05mol}{0.25L}$=0.2mol/L,由电荷守恒可知,原混合溶液中c(K+)为:0.5mol/L×2-0.2mol/L×2=0.6mol/L,故D正确;
故选C.
点评 本题考查电解原理的应用,题目难度中等,明确发生的电极反应及电子守恒是解答本题的关键,注意氢氧根离子与氢离子的关系和电解质溶液中电荷守恒的计算应用.

练习册系列答案
相关题目
3.下列有关电化学原理的说法错误的是( )
| A. | 可充电的电池称“二次电池”,在充电时,是将电能装化为化学能,在放电时,又将化学能转化为电能 | |
| B. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| C. | 对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 | |
| D. | 氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝 |
4.下列说法不正确的是( )
| A. | 丁烷有2种同分异构体,它们的物理和化学性质都不相同 | |
| B. | 在一定条件下,苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 聚合物( 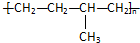 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 |
1.下列金属防腐蚀的方法中,使用外加电流的阴极保护法的是( )
| A. | 水中的钢闸门连接电源负极 | B. | 在锅炉内壁装上镁合金 | ||
| C. | 汽车底盘喷涂高分子膜 | D. | 在铁板表面镀锌 |
8.根据有机物的系统命名法,下列命名正确的是( )
| A. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| B. | CH2=CH(CH3)C=CH2 2-甲基-1,3-二丁烯 | |
| C. | CH2(OH)CH2CH2CH2OH 1,4-二羟基丁醇 | |
| D. | CH3CH2CHClCCl2CH3 2,2,3-三氯戊烷 |
18.下列反应中,既属于氧化还原反应,又属于吸热反应的是( )
| A. | 锌片与稀硫酸的反应 | B. | 灼热的碳与水蒸气的反应 | ||
| C. | 甲烷在空气中的燃烧反应 | D. | Ba(OH)2•8H2O与NH4Cl的反应 |
5.短周期元素的四种离子aW3+、bX+、cY2-、dZ-,它们的电子层结构相同,下列关系正确的是( )
| A. | 质子数c>d | B. | 元素的非金属性Y>Z | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径X>W |
2.下列叙述中不正确的是( )
| A. | 电解池的阳极上发生氧化反应,阴极上发生还原反应 | |
| B. | 原电池的正极上发生氧化反应,负极上发生还原反应 | |
| C. | 粗铜精炼时,粗铜应与直流电源的正极相连 | |
| D. | 用原电池做电源进行电解时,电子从原电池负极流向电解池阴极 |
3.下列说法正确的是( )
| A. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 | |
| B. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| C. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生 | |
| D. | 100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |