题目内容
【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)。
2NH3(g)。
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量。
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是________________________。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是______mol/(Lmin);10秒末NH3的浓度是______mol/L;N2 的的物质的量________mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
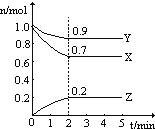
(1)该反应的化学方程式为_______________________。
(2)从开始至2min,Z的平均反应速率为____________mol/(L·min);
(3)改变下列条件,可以加快化学反应速率的有_________。
A.升高温度 B.减小物质X的物质的量 C.减小压强 D.增加物质Z的物质的量 E.缩小容积
F.使用效率更高的催化剂
(4)该反应正向为放热反应若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将______。
a.延长 b.缩短 c.不变 d.无法确定
【答案】> abe 0.075 0.5 1.5 3X+Y![]() 2Z 0.05 ADEF b
2Z 0.05 ADEF b
【解析】
Ⅰ.(1)反应热△H=反应物键能总和-生成物键能总和,当反应物的总能量>生成物的总能量时此反应为放热反应;
(2)①根据平衡状态是动态平衡,其特征是平衡体系中各物质的量不再随时间变化而变化,据此逐一分析判断;
②向2L密闭容器中加入2molN2、6 molH2,在适当的催化剂作用下,发生反应N2(g)+3H2(g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5molH2,则
2NH3(g),10min后达到平衡,此时剩余4.5molH2,则
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol) 2 6 0
转化量(mol) 0.5 1.5 1.0
平衡量(mol) 1.5 4.5 1.0
根据反应速率的公式进行计算即可;
Ⅱ.(1)从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3mol、0.1mol,Z的生成的物质的量为0.2mol,因此三者比例为3:1:2,物质的量变化之比等于化学计量数之比,据此写出反应方程式;
(2)根据反应速率为v(Z)=![]() 计算;
计算;
(3)根据影响反应速率的因素分析判断;
(4)若上述容器为绝热容器(与外界无热交换),该反应的正反应为放热反应,所以相当于升高温度,结合温度对速率的影响分析。
Ⅰ.(1)由题中数据可知:N2(g)+3H2(g)2NH3(g) △H=反应物键能总和-生成物键能总和=945.8kJ/mol+3×435.9kJ/mol-6×390.8kJ/mol=-91.3kJ/mol,所以该反应为放热反应,即反应物的总能量>生成物的总能量;
(2)①a.该反应反应前后气体的体积不等,故混合气体的总压强不再发生变化可作为判断是否达到化学平衡状态的依据,故a正确;b.v(H2)正=v(H2)逆,说明正逆反应速率相等,可作为判断是否达到化学平衡状态的依据,故b正确;c.平衡时N2和H2的浓度浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,不能判断是否达到化学平衡状态,故c错误;d.单位时间内2molNH3生成为正反应速率,同时有3moH—H键断裂也为正反应速率,均为正反应速率,不能判断是否达到化学平衡状态,故d错误;e.NH3的浓度不再改变,说明反应达到平衡状态,故e正确;故答案为abe;
②向2L密闭容器中加入2molN2、6 molH2,在适当的催化剂作用下,发生反应N2(g)+3H2(g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5molH2,则
2NH3(g),10min后达到平衡,此时剩余4.5molH2,则
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol) 2 6 0
转化量(mol) 0.5 1.5 1.0
平衡量(mol) 1.5 4.5 1.0
0~10min内的平均反应速率v(H2)=![]() =0.075mol/(Lmin);平衡时NH3的浓度是
=0.075mol/(Lmin);平衡时NH3的浓度是![]() =0.5mol/L;N2的的物质的量1.5mol;
=0.5mol/L;N2的的物质的量1.5mol;
Ⅱ.(1)从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3mol、0.1mol,Z的生成的物质的量为0.2mol,因此三者比例为3:1:2,物质的量变化之比等于化学计量数之比,则化学方程式为3X+Y![]() 2Z;
2Z;
(2)从开始至2min,Z的平均反应速率为v(Z)=![]() =
=![]() =0.05mol/(Lmin);
=0.05mol/(Lmin);
(3)A.升高温度,加快反应速率,故A正确;B.减小物质X的物质的量,减小X的浓度,化学反应速率降低,故B错误;C.减小压强,减缓化学反应速率,故C错误;D.增加物质Z的物质的量,增加Z的浓度,反应速率加快,故D正确; E.缩小容积,增大反应物的浓度,反应速率加快,故E正确;F.使用效率更高的催化剂,加快反应速率,故F正确;故答案为ADEF;
(4)若上述容器为绝热容器(与外界无热交换),该反应的正反应为放热反应,所以相当于升高温度,反应速率加快,则缩短到达平衡所需时间,故答案为b。

 阅读快车系列答案
阅读快车系列答案【题目】下列反应中产生气泡最快的是 ( )
温度 | 浓度 | 催化剂 | |
A | 25 ℃ | 2 mL 5% H2O2 | 0.1 mol·L-1 FeCl3 2滴 |
B | 35 ℃ | 2 mL 8% H2O2 | MnO2粉末 |
C | 25 ℃ | 2 mL 5% H2O2 | MnO2粉末 |
D | 25 ℃ | 2 mL 8% H2O2 | 无 |
A.AB.BC.CD.D





