题目内容
【题目】下列各种说法中不正确的是![]()
![]()
A. 在水中氢、氧原子间均以共价键相结合
B. 离子键是阳离子、阴离子的静电作用
C. ![]() 和
和![]() 的反应过程涉及了共价键的断裂和形成
的反应过程涉及了共价键的断裂和形成
D. 金属具有金属光泽及良好的导电性和导热性,这些性质均与金属键有关
【答案】A
【解析】A项,在水中H、O原子间存在共价键和氢键;B项,离子键是阳离子、阴离子的静电作用;C项,化学反应的本质是反应物中化学键的断裂和生成物化学键的形成过程;D项,金属具有金属光泽、良好的导电性和导热性都与金属键有关。
A项,在水中H、O原子间存在共价键和氢键,A项错误;B项,离子键是阳离子、阴离子的静电作用,B项正确;C项,化学反应的本质是反应物中化学键的断裂和生成物化学键的形成过程,H2和Cl2反应生成HCl,反应过程中断裂H—H键和Cl—Cl键、形成H—Cl键,C项正确;D项,由于自由电子可吸收所有频率的光,然后很快释放出各种频率的光,金属具有金属光泽,在外加电场作用下金属中的自由电子做定向移动形成电流,金属具有良好的导电性,自由电子在运动过程中与金属阳离子发生碰撞,引起能量的交换,金属具有良好的导热性,金属具有金属光泽、良好的导电性和导热性都与金属键有关, D项正确;答案选A。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)。
2NH3(g)。
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量。
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是________________________。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是______mol/(Lmin);10秒末NH3的浓度是______mol/L;N2 的的物质的量________mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
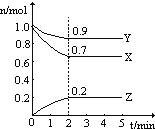
(1)该反应的化学方程式为_______________________。
(2)从开始至2min,Z的平均反应速率为____________mol/(L·min);
(3)改变下列条件,可以加快化学反应速率的有_________。
A.升高温度 B.减小物质X的物质的量 C.减小压强 D.增加物质Z的物质的量 E.缩小容积
F.使用效率更高的催化剂
(4)该反应正向为放热反应若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将______。
a.延长 b.缩短 c.不变 d.无法确定