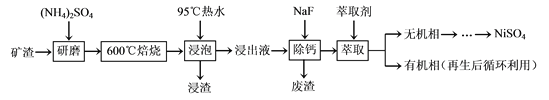
题目内容
【题目】将16mLNO和NH3的混合气体在催化剂作用下,400℃左右发生下列反应:6NO+4NH3![]() 5N2+6H2O(g)。已知反应达平衡后,在相同条件下混合气体的体积变为17mL,则在原混合气体中,NO和NH3的物质的量之比可能是
5N2+6H2O(g)。已知反应达平衡后,在相同条件下混合气体的体积变为17mL,则在原混合气体中,NO和NH3的物质的量之比可能是![]()
![]()
①3:1②3:2③3:3 ④3:4 ⑤3:5
A.①②B.①⑤C.②③④D.④⑤
【答案】C
【解析】
根据反应方程式6NO+4NH3![]() 5N2+6H2O(g) △V(增大)可知:反应消耗6体积NO,会同时消耗4体积氨气,反应产生5体积N2和6体积的水蒸气,由反应前到反应后气体体积增大(5+6)-(6+4)=1,现在是16mL反应物反应后气体体积变为17mL,增大了1mL,则反应消耗6mLNO、4mLNH3,反应产生5mLN2、6mLH2O(g),反应后NO和NH3的混合气体中剩余的气体体积为V(剩余)=16mL-(6mL+4mL)=6mL;
5N2+6H2O(g) △V(增大)可知:反应消耗6体积NO,会同时消耗4体积氨气,反应产生5体积N2和6体积的水蒸气,由反应前到反应后气体体积增大(5+6)-(6+4)=1,现在是16mL反应物反应后气体体积变为17mL,增大了1mL,则反应消耗6mLNO、4mLNH3,反应产生5mLN2、6mLH2O(g),反应后NO和NH3的混合气体中剩余的气体体积为V(剩余)=16mL-(6mL+4mL)=6mL;
若剩余NO,则原混合气体中NO体积V(NO)=6mL+6mL=12mL,V(NH3)=4mL,V(NO):V(NH3)=12mL:4mL=3:1,根据V=n·Vm可知在原混合气体中NO和NH3的物质的量之比n(NO):n(NH3)=3:1;
若剩余气体为NH3,则原混合气体中NH3的体积V(NH3)=6mL+4mL=10mL,V(NO)=6mL,在原混合气体中NO和NH3的物质的量之比n(NO):n(NH3)=6:10=3:5;
此反应为可逆反应不可能进行完全所以比值应处于3:1~3:5之间,即处于①⑤之间,故答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别可以是
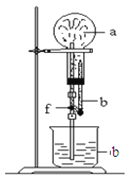
干燥气体a | 液体b | |
A | NO2 | 水 |
B | C12 | 饱和食盐水 |
C | NH3 | 水 |
D | CO2 | 4 mol·L—1NaOH溶液 |
A.AB.BC.CD.D