题目内容
【题目】标准状况下,三个烧瓶分别盛①等体积的NH3和N2的混合气、②等体积的NO2与O2的混合气、③纯净的NO2气体,将它们分别倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为
A.5:4:5B.1:1:1C.15:10:12D.无法计算
【答案】A
【解析】
①等体积的NH3和N2的混合气烧瓶倒立在水槽中时,氨气溶解水,水会充满氨气所占的体积,即溶液体积等于氨气体积,设氨气为1L,则溶液也为1L,此时溶液物质的量浓度为 ;
;
②等体积的二氧化氮与氧气的混合气通入通入水中,反应的总方程式为:4NO2+O2+2H2O=4HNO3,氧气过量,假设气体各有4mol,则4mol二氧化氮完全反应消耗1molO2、生成4molHNO3,而进入烧瓶内溶液体积等于5mol气体的体积,故c(HNO3)=![]() ;
;
③二氧化氮气体通入水中,反应方程式为:3NO2+H2O=2HNO3+NO,假设NO2的物质的量为1mol,根据方程式知,水会充入烧瓶的体积为![]() ,溶液中的溶质是硝酸,其物质的量是
,溶液中的溶质是硝酸,其物质的量是![]() ,故c(HNO3)=
,故c(HNO3)=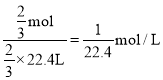 ,所以三种溶液中溶质的物质的量浓度之比为
,所以三种溶液中溶质的物质的量浓度之比为![]() :(
:(![]() ):
):![]() =5:4:5,故答案选A。
=5:4:5,故答案选A。

练习册系列答案
相关题目
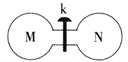
【题目】常温下,向如图所示的两个容积相同的刚性容器中分别充入气体M、N(如表所示),使两容器中压强相等。打开开关k,两容器中的气体充分混合后,恢复至常温,容器内的气体压强(固体影响忽略不计)由大到小的顺序正确的是 ( )
装置 | 编号 |
|
|
|
|
| M | NH3 | HI | NO | H2 |
N | Cl2 | Cl2 | O2 | O2 |
A.①=④>②=③ B.①=④>②>③
C.④>①>②>③D.①>④>②>③