题目内容
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
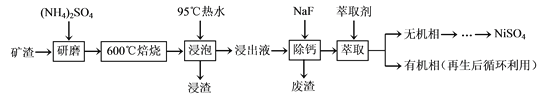
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。
(1)焙烧过程中NiFe2O4发生反应的化学方程式是___。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___,“浸渣”的成分除Fe2O3、FeO(OH)、Fe(OH)3外还含有___、___(填化学式)。
(3)“浸泡”过程中温度低于95℃,可能导致的主要问题有___(写出一点即可)。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___mol·L-1。[已知Ksp(CaF2)=4.0×10-11]
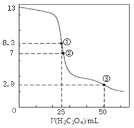
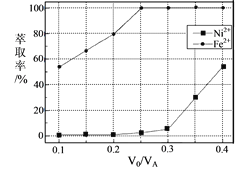
(5)本工艺中,萃取剂与溶液的体积比(![]() )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,![]() 的最佳取值是___。
的最佳取值是___。
【答案】NiFe2O4+4(NH4)2SO4=NiSO4+Fe2(SO4)2+8NH3↑+4H2O或NiFe2O4+4H2SO4=Ni2SO4+ Fe2(SO4)2+4H2O Fe3++2H2O![]() FeO(OH)↓+3H+ SiO2 CaSO4 硫酸镍溶解速率降低、Fe3+水解程度减小,使溶液中留存更多Fe3+ 2.0×10-3 0.25
FeO(OH)↓+3H+ SiO2 CaSO4 硫酸镍溶解速率降低、Fe3+水解程度减小,使溶液中留存更多Fe3+ 2.0×10-3 0.25
【解析】
某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵研磨后,600°C焙烧,已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4.NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3,在90°C的热水中浸泡过滤得到浸出液,加入NaF除去钙离子,过滤得到滤液加入萃取剂得到无机相和有机相,无机相通过一系列操作得到硫酸镍,有机相循环使用,以此解答该题。
(1)焙烧过程中加入硫酸铵生成NiSO4、Fe2(SO4)3、NH3,NiFe2O4发生反应的化学方程式为NiFe2O4+4(NH4)2SO4![]() NiSO4+Fe2(SO4)3+8NH3↑+4H2O;
NiSO4+Fe2(SO4)3+8NH3↑+4H2O;
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为Fe3++2H2O![]() FeO(OH)↓+3H+,“浸渣”的成分除Fe2O3、FeO(OH)外还含有SiO2、CaSO4;
FeO(OH)↓+3H+,“浸渣”的成分除Fe2O3、FeO(OH)外还含有SiO2、CaSO4;
(3)为防止硫酸镍溶解速率降低、Fe3+水解程度减小,避免溶液中留存更多Fe3+,则“浸泡”过程中温度应不能低于95℃;
(4)浸出液”中c(Ca2+)=1.0×10-3molL-1,当除钙率达到99%时,剩余钙离子0.1%×1.0×10-3molL-1=1×10-6mol/L,溶液中c(F-)= =
=![]() =2×10-2mol/L;
=2×10-2mol/L;
(5)本工艺中,萃取剂与溶液的体积比(![]() )对溶液中Ni2+、Fe2+的萃取率影响如图2所示,最佳取值是亚铁离子能被萃取,镍离子不被萃取,
)对溶液中Ni2+、Fe2+的萃取率影响如图2所示,最佳取值是亚铁离子能被萃取,镍离子不被萃取,![]() 的最佳取值是0.25。
的最佳取值是0.25。

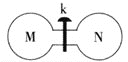
【题目】常温下,向如图所示的两个容积相同的刚性容器中分别充入气体M、N(如表所示),使两容器中压强相等。打开开关k,两容器中的气体充分混合后,恢复至常温,容器内的气体压强(固体影响忽略不计)由大到小的顺序正确的是 ( )
装置 | 编号 |
|
|
|
|
| M | NH3 | HI | NO | H2 |
N | Cl2 | Cl2 | O2 | O2 |
A.①=④>②=③ B.①=④>②>③
C.④>①>②>③D.①>④>②>③
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D