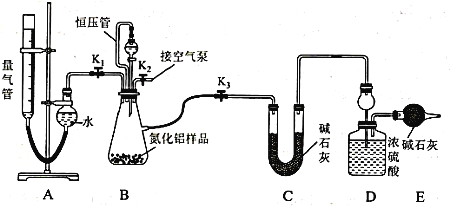
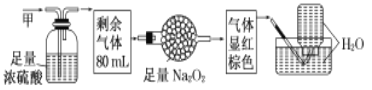
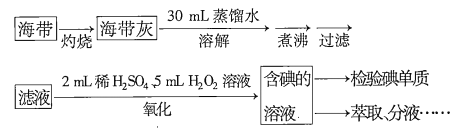
题目内容
【题目】Cu 与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH 溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图所示:
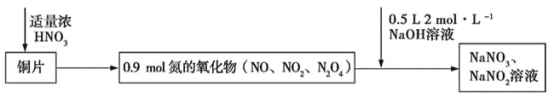
下列有关判断正确的是
A.若铜片为51.2 g,则生成0.2 mol NaNO3
B.常温下,Cu 遇浓硝酸发生钝化,不可能发生上述反应
C.标准状况下收集的氮氧化物为20.16 L
D.反应过程中生成的Cu(NO3)2既是氧化产物,也是还原产物
【答案】A
【解析】
A、51.2gCu的物质的量是51.2g÷64g/mol=0.8mol,Cu失去电子的物质的量是0.8mol×2=1.6mol,铜和硝酸反应铜还原硝酸生成氮氧化合物,氮的氧化物与0.5L2mol/L氢氧化钠溶液反应生成硝酸钠和亚硝酸钠,相当于铜失去电子给了硝酸与氢氧化钠反应生成亚硝酸钠,所以1.6mol=n(NaNO2)×2,解得n(NaNO2)=0.8mol,根据钠元素守恒,则生成硝酸钠的物质的量是0.5L×2mol/L-0.8mol=0.2mol,A正确;
B、常温下,Cu与浓硝酸反应不会发生钝化,B错误;
C、常温下气体的物质的量为0.9mol,当在标准状况下时,二氧化氮与四氧化二氮之间存在平衡,则混合气体的物质的量一定不是0.9mol,所以氮氧化物的体积不是20.16L,C错误;
D、Cu被氧化成铜离子,所以硝酸铜只是氧化产物,D错误;
答案选A。

练习册系列答案
相关题目