��Ŀ����
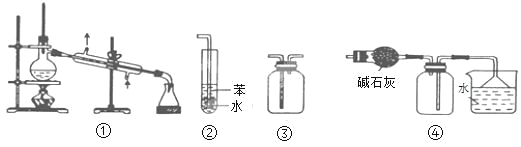
����Ŀ��ijͬѧ��̽��Na2O2��ˮ�ķ�Ӧ���ɹ�ʹ�õ��Լ��У�Na2O2������ˮ��KMnO4������Һ��MnO2����ͬѧȡ4 g Na2O2��Ʒ�����ˮ��Ӧ������ȫ��Ӧ��100 mL��ҺX��448 mL O2��������Ϊ��״��������ͬѧ�ƲⷴӦ�п���������H2O2��������ʵ��̽����
�������ʵ��֤����ҺX�к���������_________________��
��ͨ������ʵ��֤����Һ��ȷʵ����H2O2��ȡ����X���Թ��У��μӼ��η�̪��Һ��ʵ������Ϊ___________��
��ȡ����X���Թ��У��μ�FeCl2��Һ���������ɺ��ɫ��������÷�Ӧ�����ӷ���ʽΪ___________��
����֪��ҺX��ʹ����KMnO4��Һ��ɫ��ͬʱ�ų���������ɲ���ƽ�÷�Ӧ�����ӷ���ʽ��____
![]() ________MnO4-+ ________H2O2 + ________H+ �� ________Mn2+ + ________O2�� + __________��
________MnO4-+ ________H2O2 + ________H+ �� ________Mn2+ + ________O2�� + __________��
ȡ100 mL ��ҺX��ʹ�����������KMnO4��Һ��Ӧ����������224 mL O2��������Ϊ��״�����������Ʒ��Na2O2������������___________��
���𰸡� ȡ������ҺX��������MnO2������������KMnO4��Һ����������ɫ����ų���������ʹ�����ǵ�ľ����ȼ������֤��X�к��������� ��Һ�ȱ�����ɫ 2Fe2+ + 4OH-+ H2O2��2Fe(OH)3�� 2��5��6��2��5��8H2O 97.5 %
�����������⿼��ʵ�鷽����������ۣ���1������H2O2������H2O2��MnO2�����·ֽ��������������ʹ������ľ����ȼ�����������ȡ������ҺX��������MnO2������������KMnO4��Һ����������ɫ����ų���������ʹ�����ǵ�ľ����ȼ������֤��X�к��������⣻��2��Na2O2��H2O��Ӧ�����������ƣ�����ҺX�к���NaOH��H2O2���μӷ�̪��Һ����Һ�ȱ�죬��ΪH2O2����ǿ�����ԣ��ܰ���ɫ��������Ư�ף������������Һ�ȱ�����ɫ����3����ҺX�к���NaOH��H2O2���μ�FeCl2��Һ�������������ɫ�������˳���ΪFe(OH)3��H2O2��Fe2��������Fe3�������ӷ�Ӧ����ʽΪ2Fe2�� + 4OH��+ H2O2��2Fe(OH)3������4��MnO4����Mn�Ļ��ϼ��ɣ�7�ۡ���2�ۣ����ϼ۽���5��H2O2��O�Ļ��ϼ��ɣ�1�ۡ�0�ۣ�H2O2���廯�ϼ�����2�ۣ���С������Ϊ10��MnO4����Mn2����ϵ��Ϊ2��H2O2��O2��ϵ��Ϊ5��Ȼ�����Ԫ���غ㡢����غ㣬�ó����ӷ�Ӧ����ʽΪ2MnO4����5H2O2��6H��=2Mn2����5O2����8H2O����KMnO4��Һ��Ӧ�����������ʵ���Ϊ224��10��3/22.4mol=0.01mol��������������ʵ���Ϊ0.01mol��������H2O2��Na2O2�����ʵ���Ϊ0.01mol������������ˮ��Ӧ�����������ʵ���Ϊ448��10��3/22.4mol=0.02mol����ˮ��Ӧ��������������Na2O2�����ʵ���Ϊ0.02��2mol=0.04mol����Ʒ��Na2O2������Ϊ(0.01��0.04)��78g=3.9g���������ƵĴ���Ϊ3.9/4��100%=97.5%��

 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д� ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д� �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д� ��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
��Ԫ����ĩ��ϰ�ȷ��ϵ�д�����Ŀ��25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L����Һ����pH���±���ʾ���й�˵����ȷ����
��� | �� | �� | �� | �� |
��Һ |
|
|
|
|
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A. ����ǿ���� ![]()
B. ���ӵ���Ũ�ȣ���>��
C. ���� ![]()
D. �ں͢���![]() ���
���