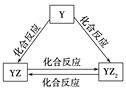
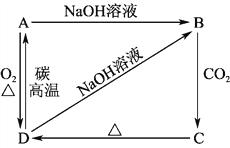
题目内容
【题目】在一定条件下,可逆反应A+BmC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问: 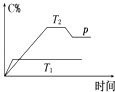
(1)温度T1T2(填“大于”“等于”或“小于”).
(2)正反应是反应(填“吸热”或“放热”).
(3)如果A、B、C均为气体,则m2(填“大于”“等于”或“小于”).
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强(填“增大”“减小”或“不变”),平衡移动(填“向正反应方向”“向逆反应方向”或“不”).
【答案】
(1)大于
(2)放热
(3)大于
(4)增大;不
【解析】解:(1.)由图可知,温度为T1 先到达平衡,温度越高反应速率越快,到达平衡的时间越短,故T1>T2 , 所以答案是:大于;
(2.)由图可知温度T1>T2 , 温度越高C%越小,故升高温度平衡向逆反应移动,故正反应为放热反应,所以答案是:放热;
(3.)由图可知,T2温度时达到平衡后向容器加压,C%减小,故增大压强平衡向逆反应移动,增大压强平衡向气体物质的量减小的方向移动,故m>2,所以答案是:大于;
(4.)当温度和容积不变时,在平衡体系中加入一定量的某稀有气体,体系压强增大,但反应混合物的浓度不变,平衡不移动,所以答案是:增大;不.

 阅读快车系列答案
阅读快车系列答案【题目】卤块的主要成分是MgCl2 , 此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁. 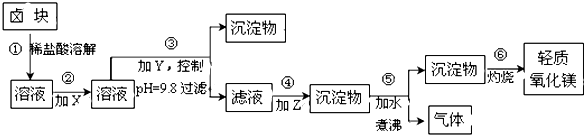
查阅资料得下表相关数据:
表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽.
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X,Y,Z最佳选择依次是表2中的(选填试剂编号).
(2)步骤②发生反应的离子方程式为;步骤⑤中发生反应的化学方程为 .
(3)步骤③控制pH=9.8的目的是 .
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、和泥三角.
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因 .
【题目】在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O42NO2 , 隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40s内用N2O4表示的平均反应速率为molL﹣1s﹣1 .
(2)计算在80℃时该反应的平衡常数K= .
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有(填字母).
a.增大N2O4起始浓度
b.向混合气体中通入NO2
c.使用高效催化剂
d.升高温度.
【题目】某化学小组在实验室模拟用软锰矿(主要成分![]() ,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
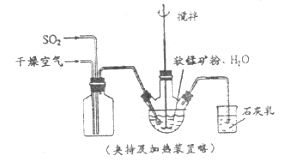
①缓慢向烧瓶中(见上图)通入过量混合气进行“浸锰”操作,主要反应原理为: ![]()
![]() (铁浸出后,过量的
(铁浸出后,过量的![]() 会将
会将![]() 还原为
还原为![]() )
)
②向“浸锰”结束后的烧瓶中加入一定量纯![]() 粉末。
粉末。
③再用![]() 溶液调节pH为3.5左右,过滤。
溶液调节pH为3.5左右,过滤。
④调节滤液pH为6.5-7.2,加入![]() ,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
(1)“浸锰”反应中往往有副产物![]() 的生成,温度对“浸锰”反应的影响如下图,为减少
的生成,温度对“浸锰”反应的影响如下图,为减少![]() 的生成,“浸锰”的适宜温度是___________。
的生成,“浸锰”的适宜温度是___________。
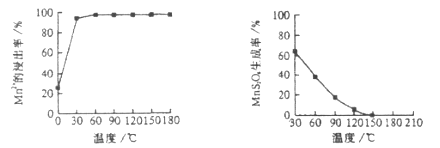
图1 温度对锰浸出率的影响 图2 浸锰温度与![]() 生成率的关系
生成率的关系
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是________。②中加入一定量纯![]() 粉末的主要作用是_________,相应反应的离子方程式为_______。
粉末的主要作用是_________,相应反应的离子方程式为_______。
表1:生成相应氢氧化物的pH
物质 |
|
|
|
|
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(3)③中所得的滤液中含有![]() ,可添加过量的难溶电解质MnS除去
,可添加过量的难溶电解质MnS除去![]() ,经过滤,得到纯净的
,经过滤,得到纯净的![]() 。用平衡移动原理解释加入MnS的作用__________。
。用平衡移动原理解释加入MnS的作用__________。
(4)④中加入![]() 后发生反应的离子方程式是__________。
后发生反应的离子方程式是__________。