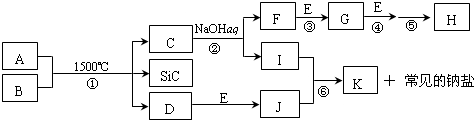
题目内容
15.现有部分原子序数小于18 的元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
 .
.(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(5)探寻物质的性质差异性是学习的重要方法之一.X、Y、Z三种元素的单质中化学性质明显不同于其他两种单质的是Al(用元素符号表示),理由Al为金属单质,其余为非金属单质.
分析 X元素原子最外层电子数是次外层电子数的2倍,X原子只能有2个电子层,最外层电子数为4,则X为碳元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为氮元素;Z元素原子最外层电子数比次外层电子数少5个电子,原子序数小于18,Z原子有3个电子层,最外层电子数为3,故Z为Al,据此解答.
解答 解:X元素原子最外层电子数是次外层电子数的2倍,X原子只能有2个电子层,最外层电子数为4,则X为碳元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为氮元素;Z元素原子最外层电子数比次外层电子数少5个电子,原子序数小于18,Z原子有3个电子层,最外层电子数为3,故Z为Al,
(1)碳元素的一种同位素可测定文物年代:这种同位素的符号是146C,Z为Al元素,质子数为13,离子核外有2个电子层,各层电子数为2、8,其原子结构示意图为: ,
,
故答案为:146C; ;
;
(2)N元素与氢元素形成一种离子为NH4+,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+,
故答案为:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+;
(3)Z元素最高价氧化物对应的水化物为Al(OH)3,与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(4)C、N同周期,随原子序数增大非金属性增强,故N元素非金属性较强,
a.单质的状态属于物理性质,不能比较非金属性强弱,故a错误;
b.Y(N元素)的最高价氧化物水化物的酸性比X(碳)的最高价氧化物水化物的酸性强,说明Y(N)的非金属性更强,故b正确;
c.X(碳)与Y(N)形成的化合物中X元素呈正价态,说明Y(N)元素对键合电子吸引能力更强,Y(N)的非金属性更强,故c正确,
故答案为:N;bc;
(5)Al为金属单质,其余为非金属单质,Al的性质不同于其他两种单质,
故答案为:Al;Al为金属单质,其余为非金属单质.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,侧重对基础知识的巩固.


| A. | 钢铁发生吸氧腐蚀时,电子流动方向可用图甲示意图表示 | |
| B. | 钢铁水闸在发生吸氧腐蚀时,产生铁锈最多的位置在图乙d处 | |
| C. | 用牺牲阳极保护法保护钢铁水闸时,可用图丙所示装置示意 | |
| D. | 用外接电源阴极保护法保护钢铁水闸时,可用图丁所示装置示意 |
| A. | 四氯化碳的电子式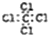 | B. | C2H4的球棍模型 | ||
| C. | 环已烷的结构简式 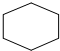 | D. | 次氯酸的结构式:H-Cl-O |
| A. | 负极的反应式为CH3OH+H2O-6e-═CO2↑+6H+ | |
| B. | 氧气在电极上的反应是O2+4H++4e-═2H2O | |
| C. | 电池工作时,H+由正极移向负极 | |
| D. | 电池工作时,电子从通入甲醇的一极流出,经外电路流入通入氧气的一极 |
| 序号 | 物质 | 试剂 | 分离方法 |
| ① | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ② | 溴苯(溴) | NaOH溶液 | 分液 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(环己烷) | 水 | 分液 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ④③ |
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
(2)能与溴水反应使之褪色的烃是(填序号):③.
(3)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为nCH2=CH2$\stackrel{催化剂}{→}$

(4)能使酸性高锰酸钾褪色的烃是(填结构简)CH2=CH2、
 、
、 .
.(4)彼此互为同系物的是(填序号):④⑤.
(5)甲苯的一氯取代产物的有4种,请写出甲苯的一氯取代产物结构简式:
 .
. 
 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为:先产生蓝色沉淀,后沉消失,变成深蓝色的溶液;反应过程中的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为:先产生蓝色沉淀,后沉消失,变成深蓝色的溶液;反应过程中的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-