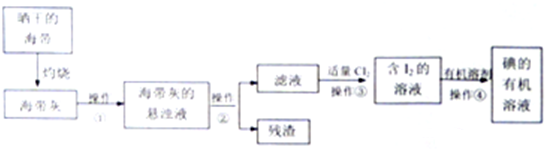
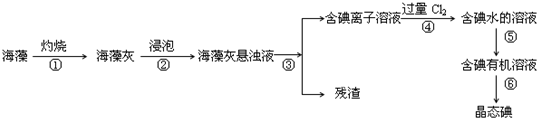
题目内容
20.甲醇燃料电池(DMFC)可用于汽车、遥感通讯设备等,它的一极通入甲醇,一极通入氧气;电解质溶液是稀硫酸.电池工作时,甲醇被氧化为二氧化碳和水.下列叙述中不正确的是( )| A. | 负极的反应式为CH3OH+H2O-6e-═CO2↑+6H+ | |
| B. | 氧气在电极上的反应是O2+4H++4e-═2H2O | |
| C. | 电池工作时,H+由正极移向负极 | |
| D. | 电池工作时,电子从通入甲醇的一极流出,经外电路流入通入氧气的一极 |
分析 甲醇燃料电池中,负极上甲醇失电子发生氧化反应,电极方程式为CH3OH+H2O-6e-═CO2↑+6H+,正极上氧气得电子发生还原反应,原电池放电时,电解质溶液中阳离子向正极移动,以此解答该题.
解答 解:A.负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极方程式为CH3OH+H2O-6e-═CO2↑+6H+,故A正确;
B.甲醇燃料电池中,电解质溶液是稀硫酸,正极上氧气得电子与氢离子结合生成水,电极反应式O2+4H++4e-═2H2O,故B正确;
C.该原电池放电时,氢离子由负极向正极移动,故C错误;
D.通入甲醇的一极为负极,通入氧气的电极为正极,电子从负极经导线流向正极,故D正确.
故选C.
点评 本题考查了原电池原理,明确元素的化合价变化、氧化还原反应与原电池反应的关系是解答本题的关系,注意电解质溶液中阴阳离子的移动方向,为易错点.

练习册系列答案
相关题目
15.现有部分原子序数小于18 的元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代:这种同位素的符号是146C(用元素符号表示)元素Z的离子结构示意图为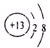 .
.
(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(5)探寻物质的性质差异性是学习的重要方法之一.X、Y、Z三种元素的单质中化学性质明显不同于其他两种单质的是Al(用元素符号表示),理由Al为金属单质,其余为非金属单质.
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
 .
.(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(5)探寻物质的性质差异性是学习的重要方法之一.X、Y、Z三种元素的单质中化学性质明显不同于其他两种单质的是Al(用元素符号表示),理由Al为金属单质,其余为非金属单质.
5.某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是( )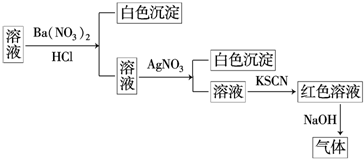

| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
12.某烃的一种同分异构体,核磁共振氢谱测得分子中只有一个吸收峰,则该烃的分子式可能为( )
| A. | C6H14 | B. | C7H16 | C. | C8H18 | D. | C9H20 |

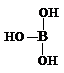 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: .
.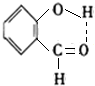 .
.