题目内容
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO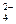 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
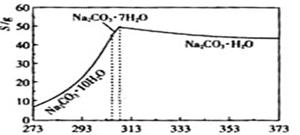

已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
小题1:(1)滤渣的主要成分为 。
小题2:(2)“趁热过滤”的原因是 。
小题3:(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
小题4:(4)若“母液”循环使用,可能出现的问题及其原因是 。
小题5:(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=" +532.36" kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1=" +473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
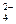 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:

已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
小题1:(1)滤渣的主要成分为 。
小题2:(2)“趁热过滤”的原因是 。
小题3:(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
小题4:(4)若“母液”循环使用,可能出现的问题及其原因是 。
小题5:(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=" +532.36" kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1=" +473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
小题1:(1)滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3。
小题2:(2)“趁热过滤”的原因是使析出的晶体为Na2CO3·H2O,防止因温度过低而析出Na2CO3·10H2O晶体,令后续的加热脱水耗时长。
小题3:(3)若在实验室进行“趁热过滤”,可采取的措施是用已预热的布氏漏斗趁热抽滤。
小题4:(4)若“母液”循环使用,可能出现的问题及其原因是问题:溶解时有大量沉淀生成,使Na2CO3损耗且产物Na2CO3混有杂质;原因:“母液”中,含有的离子有Ca2+,Na+,Cl-,SO42-,OH-,CO32-,当多次循环后,使用离子浓度不断增大,溶解时会生成CaSO4,Ca(OH)2,CaCO3等沉淀。
小题5:(5)写出Na2CO3·H2O脱水反应的热化学方程式
Na2CO3·H2O(S)="===" Na2CO3(s) + H2O(g);H= +58.73kJ/mol
小题1:(1)因工业碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、Ca(OH)2沉淀。
小题2:(2)观察坐标图,温度减少至313K时发生突变,溶解度迅速减少,弱不趁热过滤将析出晶体。
小题3:(3)思路方向:1.减少过滤的时间 2.保持过滤时的温度。
小题4:(4)思路:分析“母液”中存在的离子,若参与循环,将使离子浓度增大,对工业生产中哪个环节有所影响。
小题5:(5)通过观察两个热化学方程式,可将两式相减,从而得到Na2CO3·H2O(s)="===" Na2CO3(s)+ H2O(g)。

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目


 我国中医药已逐步进入国际市场,但国外在进口中药时对中草药中的重金属元素和有毒元素的含量等各项指标检查是非常严格的。下面是某分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
我国中医药已逐步进入国际市场,但国外在进口中药时对中草药中的重金属元素和有毒元素的含量等各项指标检查是非常严格的。下面是某分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在):