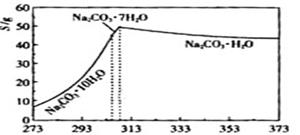
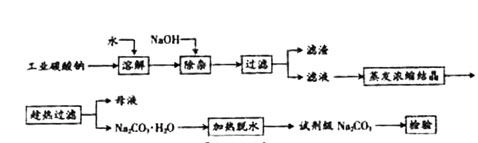
题目内容
 我国中医药已逐步进入国际市场,但国外在进口中药时对中草药中的重金属元素和有毒元素的含量等各项指标检查是非常严格的。下面是某分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
我国中医药已逐步进入国际市场,但国外在进口中药时对中草药中的重金属元素和有毒元素的含量等各项指标检查是非常严格的。下面是某分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在): ①取1.000 kg中草药样品进行灼烧、溶解、过滤等操作制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3;
①取1.000 kg中草药样品进行灼烧、溶解、过滤等操作制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3; ②将待测溶液转移入250 mL锥形瓶中,并加入2~3滴0.2%的淀粉溶液;
②将待测溶液转移入250 mL锥形瓶中,并加入2~3滴0.2%的淀粉溶液; ③用标准碘溶液滴定待测溶液至终点,消耗20.25 mL标准I2溶液,其间发生反应:
③用标准碘溶液滴定待测溶液至终点,消耗20.25 mL标准I2溶液,其间发生反应: H3AsO3+I2+H2O―→H3AsO4+I-+H+(未配平)
H3AsO3+I2+H2O―→H3AsO4+I-+H+(未配平) 试回答下列问题:
试回答下列问题: (1)过滤时需用的玻璃仪器是: 。
(1)过滤时需用的玻璃仪器是: 。 (2)配平离子反应方程式:[ ]H3AsO3+[ ]I2+[ ]H2O===[ ]H3AsO4+[ ]I-+[ ]H+
(2)配平离子反应方程式:[ ]H3AsO3+[ ]I2+[ ]H2O===[ ]H3AsO4+[ ]I-+[ ]H+ (3)判断滴定到达终点的现象是: 。
(3)判断滴定到达终点的现象是: 。 (4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.107 0 g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1 000 mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程: 。
(4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.107 0 g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1 000 mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程: 。 (5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000 mg/kg,计算可知该样品中砷含量约为 mg/kg,故该中草药样品 (填“合格”或“不合格”)。
(5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000 mg/kg,计算可知该样品中砷含量约为 mg/kg,故该中草药样品 (填“合格”或“不合格”)。 (1)漏斗、烧杯、玻璃棒 (3分)(每答对一个给1分)
(1)漏斗、烧杯、玻璃棒 (3分)(每答对一个给1分) (2)[1]H3AsO3+[1]I2+[1]H2O===[1]H3AsO4+[2]I-+[2]H+(全对方可给3分)
(2)[1]H3AsO3+[1]I2+[1]H2O===[1]H3AsO4+[2]I-+[2]H+(全对方可给3分) (3)溶液由蓝色变为无色,保持半分钟不变色 (3分)
(3)溶液由蓝色变为无色,保持半分钟不变色 (3分) (4)IO+5I-+6H+===3I2+3H2O (3分)
(4)IO+5I-+6H+===3I2+3H2O (3分) (5)2.278~2.279 (3分) 不合格 (2分)
(5)2.278~2.279 (3分) 不合格 (2分) 运用得失电子守恒法配平化学方程式,H3AsO3+I2+H2O===H3AsO4+2I-+2H+,IO+5I-+6H+===3I2+3H2O,则I2的物质的量浓度为:=0.001 5 mol/L。根据As~H3AsO3~I2,则As的质量为:0.020 255 L×
运用得失电子守恒法配平化学方程式,H3AsO3+I2+H2O===H3AsO4+2I-+2H+,IO+5I-+6H+===3I2+3H2O,则I2的物质的量浓度为:=0.001 5 mol/L。根据As~H3AsO3~I2,则As的质量为:0.020 255 L× 0.001 5 mol/L×75 g/mol=0.002 278 125 g≈2.278mg,即As的含量为2.278mg/kg,故该中草药样品不合格。
0.001 5 mol/L×75 g/mol=0.002 278 125 g≈2.278mg,即As的含量为2.278mg/kg,故该中草药样品不合格。 本题考查氧化还原反应滴定实验,中等题。
本题考查氧化还原反应滴定实验,中等题。
练习册系列答案
相关题目
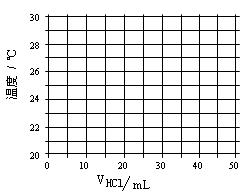
 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下: