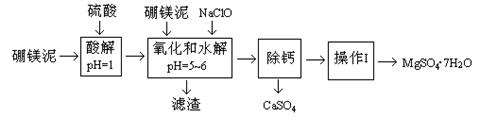
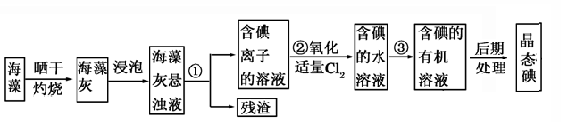
题目内容
从固体混合物A出发可以发生如下框图所示的一系列变化:
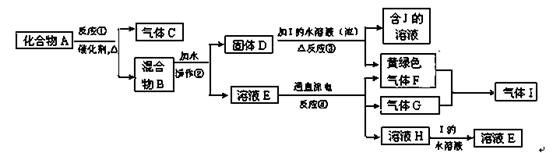
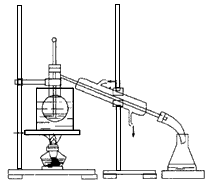
(1)在实验室中常用反应①制取气体C。若要收集气体C,可选择下图装置中的 (填字母)
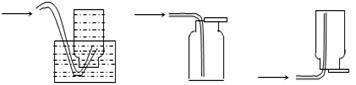
A B C
(2)操作②的名称是 ,在操作②中所使用的玻璃仪器的名称是 。
(3)写出下列反应的方程式:
反应①的化学方程式
反应③的化学方程式
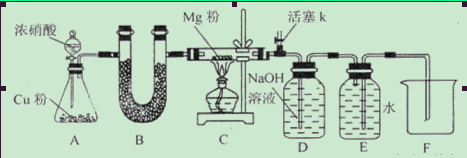
(4)在实验室中,要获得干燥纯净的黄绿色气体F, 可以将它通过下图中的装置,其中瓶I中盛放的
是 ,瓶II中盛放的是 。


(1)在实验室中常用反应①制取气体C。若要收集气体C,可选择下图装置中的 (填字母)

A B C
(2)操作②的名称是 ,在操作②中所使用的玻璃仪器的名称是 。
(3)写出下列反应的方程式:
反应①的化学方程式
反应③的化学方程式
(4)在实验室中,要获得干燥纯净的黄绿色气体F, 可以将它通过下图中的装置,其中瓶I中盛放的
是 ,瓶II中盛放的是 。
(1)A、B;(2)过滤;漏斗、玻璃棒、烧杯;(3)2KClO3 2KCl+3O2↑ MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O ;(4)饱和食盐水,浓H2SO4。
2KCl+3O2↑ MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O ;(4)饱和食盐水,浓H2SO4。
 2KCl+3O2↑ MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O ;(4)饱和食盐水,浓H2SO4。
2KCl+3O2↑ MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O ;(4)饱和食盐水,浓H2SO4。试题分析:F为黄绿色气体,则F为Cl2,反应④为二氧化锰与浓盐酸的反应,则D为MnO2,I为MnCl2,G为不溶于稀硝酸的白色固体;溶液H的焰色反应呈紫色,则G为AgCl,H为KNO3,E为KCl,混合物B为MnO2、KCl的混合物,则反应①为2KClO3
 2KCl+3O2↑,A为KClO3、MnO2的混合物,气体C为O2:(1)氧气不溶于水,可选A用排水法收集,氧气的密度比空气的大,可选B用向上排空气法收集;(2)B为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用过滤来分离,过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯,为得到固体D,应利用洗涤除去附着在MnO2表面的K+、Cl-等离子,然后再干燥,故答案为:过滤;漏斗、玻璃棒、烧杯;(3)反应①的化学方程式为2KClO3
2KCl+3O2↑,A为KClO3、MnO2的混合物,气体C为O2:(1)氧气不溶于水,可选A用排水法收集,氧气的密度比空气的大,可选B用向上排空气法收集;(2)B为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用过滤来分离,过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯,为得到固体D,应利用洗涤除去附着在MnO2表面的K+、Cl-等离子,然后再干燥,故答案为:过滤;漏斗、玻璃棒、烧杯;(3)反应①的化学方程式为2KClO3 2KCl+3O2↑,反应④的离子反应为MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O;(4)要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,故答案为:饱和食盐水,浓H2SO4。
2KCl+3O2↑,反应④的离子反应为MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O;(4)要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,故答案为:饱和食盐水,浓H2SO4。
练习册系列答案
相关题目
 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑; 2CrO42- + 2H+
2CrO42- + 2H+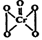 ), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。
), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。