题目内容
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
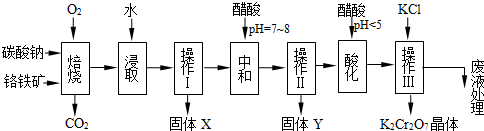
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、
过滤、_______、干燥。
(4)右表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
(5)酸性溶液中过氧化氢能使Cr2O72-生成蓝色的过氧化铬(CrO5分子结构为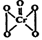 ), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。
), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。
该反应 (填“属于”或“不属于”)氧化还原反应。
(6)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/ L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32—=2I-+S4O62—)。
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为 。(保留3位有效数字, K2Cr2O7的摩尔质量为294g/mol)。

已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2
 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;②Na2CO3 + Al2O3
 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、
过滤、_______、干燥。
(4)右表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
(5)酸性溶液中过氧化氢能使Cr2O72-生成蓝色的过氧化铬(CrO5分子结构为
 ), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。
), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。该反应 (填“属于”或“不属于”)氧化还原反应。
(6)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/ L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32—=2I-+S4O62—)。
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为 。(保留3位有效数字, K2Cr2O7的摩尔质量为294g/mol)。
(16分)(1)Fe2O3、MgO(2分,有错即为0分,少一个扣1分);pH计或精密pH试纸。(1分,
答pH试纸或广泛pH试纸不给分)
(2)使CrO42-转化为Cr2O72-。(1分) (3)冷却结晶、洗涤。(各1分)
(4)K2Cr2O7的溶解度比Na2Cr2O7小(1分)(或四种物质中K2Cr2O7的溶解度最小)。
(5)Cr2O72- + 4H2O2 +2H+= 2CrO5 + 5H2O (2分) 不属于(1分)
(6)①溶液蓝色恰好褪色为滴定终点(2分)
②94.1%(4分,在±0.1%范围内不扣分,有效数字错扣2分)
答pH试纸或广泛pH试纸不给分)
(2)使CrO42-转化为Cr2O72-。(1分) (3)冷却结晶、洗涤。(各1分)
(4)K2Cr2O7的溶解度比Na2Cr2O7小(1分)(或四种物质中K2Cr2O7的溶解度最小)。
(5)Cr2O72- + 4H2O2 +2H+= 2CrO5 + 5H2O (2分) 不属于(1分)
(6)①溶液蓝色恰好褪色为滴定终点(2分)
②94.1%(4分,在±0.1%范围内不扣分,有效数字错扣2分)
试题分析:(1)铬铁矿的主要成分可表示为FeO?Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,因此加入氧气和碳酸钠发生反应为①4FeO?Cr2O3+8Na2CO3+7O2
 8Na2CrO4+2Fe2O3+8CO2↑、②Na2CO3+Al2O3
8Na2CrO4+2Fe2O3+8CO2↑、②Na2CO3+Al2O3 2NaAlO2+CO2↑、③Cr2O72-+H2O
2NaAlO2+CO2↑、③Cr2O72-+H2O 2CrO42-+2H+。氧化铁、氧化铝不溶于水,操作Ⅰ是过滤,因此得到固体X为Fe2O3、MgO。要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸。
2CrO42-+2H+。氧化铁、氧化铝不溶于水,操作Ⅰ是过滤,因此得到固体X为Fe2O3、MgO。要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸。(2)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr2O72-+H2O
 2CrO42-+2H+可知,加入酸,溶液中氢离子浓度增大,平衡左移,所以目的是使CrO42-转化为Cr2O72-。
2CrO42-+2H+可知,加入酸,溶液中氢离子浓度增大,平衡左移,所以目的是使CrO42-转化为Cr2O72-。(3)对于易溶性物质,从溶液得到晶体的操作一般是蒸发浓缩、冷却结晶、过滤,将得到的晶体洗涤干燥即可。因此要获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体。
(4)依据表中物质的溶解度数据分析对比,依据操作Ⅲ发生反应的化学方程式Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl可知,该反应之所以能发生是因为K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小)。
(5)酸性溶液中过氧化氢能使Cr2O72-生成蓝色的过氧化铬,由于溶液显酸性,因此反应物还有氢离子参加,根据原子守恒可知,生成物还有水生成,因此反应的离子方程式为Cr2O72- + 4H2O2 +2H+=2CrO5 + 5H2O。根据CrO5分子结构
 可知,该化合物中Cr元素的化合价仍然是+6价,其中氧元素的化合价有4个-1价的,1个-2价的,因此该反应前后元素的化合价均没有发生变化,所以反应不是氧化还原反应。
可知,该化合物中Cr元素的化合价仍然是+6价,其中氧元素的化合价有4个-1价的,1个-2价的,因此该反应前后元素的化合价均没有发生变化,所以反应不是氧化还原反应。(6)①由于碘单质遇淀粉显蓝色,所以根据反应I2+2S2O32—=2I-+S4O62—可知,判断达到滴定终点的依据是溶液蓝色恰好褪色且半分钟不恢复即为滴定终点。
②根据反应Cr2O72-+6I-+14H+=2Cr3++3I2+ 7H2O、I2+2S2O32—=2I-+S4O62—可知
Cr2O72-~~~3I2~~~6S2O32—
1mol 6mol
n(K2Cr2O7) 0.1200mol/L×0.04L
即
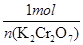 =
=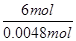
解得n(K2Cr2O7)=0.0008mol
所以2.500g重铬酸钾试样中重铬酸钾的物质的量=
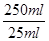 ×0.0008mol=0.008mol
×0.0008mol=0.008mol质量=0.008mol×294g/mol=2.352g
因此所得产品中重铬酸钾的纯度为
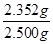 ×100%=94.1%
×100%=94.1%
练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目

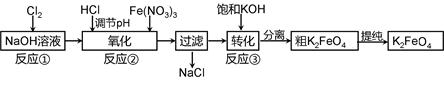
 4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。