题目内容
5.能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
(1)如图1所示,组成一个原电池.
①当电解质溶液为稀硫酸时:Cu电极的电极反应式为2H++2e-=H2↑;
②当电解质溶液为浓硝酸时:Cu电极是负(填“正”或“负”)极.
(2)①若用惰性电极电解某CuSO4溶液.请写出开始电解时反应的总化学方程式2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
②若电解足量的KCl溶液,电解一段时间后,要使该溶液恢复到电解前溶液的体积和浓度,则应加入适量的氯化氢(填写物质的名称).
(3)氢气具有热值高,产物无污染等优点,是一种理想的新能源.已知4g H2完全燃烧生成液态水时放出热量为571.6kJ,试写出表示H2燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol.
(4)发射卫星时,可用肼(N2H4)为燃料和二氧化氮(NO2)作氧化剂,两者反应生成氮气和气态水.已知:
①N2(g)+2O2(g)═2NO2(g)△H=+70kJ•mol-1;
②N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=-543kJ•mol-1;
试写出液态N2H4和气态NO2反应生成气态N2和气态H2O的热化学方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1156kJ•mol-1.
(5)水煤气可作为工业上的一种能源(利用C和H2O气在高温下产生CO和H2).图2是一碳酸盐燃料电池(MCFC),以水煤气(若水煤气中CO和H2的物质的量之比为1:1)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.则B极是燃料电池的正极(填写“正极”或“负极”);写出该燃料电池的总反应式:CO+H2+O2=CO2+H2O;写出A极发生的电极反应式:CO+H2+2CO32--4e-=3CO2+H2O.
分析 (1)①当电解质溶液为稀硫酸时:Fe易失电子作负极、Cu作正极,正极上氢离子得电子生成氢气;
②当电解质溶液为浓硝酸时:铁和浓硝酸发生钝化现象,Cu易失电子作负极、Fe作正极;
(2)①用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,同时电解质溶液中还生成硫酸;
②若电解足量的KCl溶液,溶液中氯离子在阳极失电子发生氧化反应,氢离子在阴极得电子发生还原反应,根据少什么加什么分析判断;
(3)4g氢气的物质的量是2mol,2mol氢气完全燃烧生成液态水放出571.6kJ,则1mol氢气完全燃烧生成液态水放出285.8kJ热量;
(4))①N2(g)+2O2(g)=2NO2(g)△H=+70kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
依据盖斯定律②×2-①计算得到;
(5)碳酸盐燃料电池中通氧气的电极一定为正极,通入燃料的电极一定为负极,氧气在该电极上发生还原反应.
解答 解:(1)①当电解质溶液为稀硫酸时:Fe易失电子作负极、Cu作正极,正极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②当电解质溶液为浓硝酸时:铁和浓硝酸发生钝化现象,Cu易失电子作负极、Fe作正极,故答案为:负;
(2)①用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,同时电解质溶液中还生成硫酸,电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
②若电解足量的KCl溶液,溶液中氯离子在阳极失电子发生氧化反应,氢离子在阴极得电子发生还原反应,根据少什么加什么,则恢复原溶液浓度需要加入析出的物质,即加入氯化氢可以恢复,故答案为:氯化氢;
(3)4g氢气的物质的量是2mol,2mol氢气完全燃烧生成液态水放出571.6kJ,则1mol氢气完全燃烧生成液态水放出285.8kJ热量,其燃烧热化学方程式为 H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
(4)①N2(g)+2O2(g)=2NO2(g)△H=+70kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
依据盖斯定律②×2-①得到,2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1156kJ•mol-1;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1156kJ•mol-1 ;
(5)碳酸盐燃料电池中通氧气的电极一定为正极,通入燃料的电极一定为负极,则A为负极,反应为:CO+H2+2CO32--4e-=3CO2+H2O;氧气在该电极上发生还原反应,所以B为正极,反应为:2CO2+O2+4e-=2CO32-;所以总反应为:CO+H2+O2=CO2+H2O,故答案为:正极;CO+H2+O2=CO2+H2O;CO+H2+2CO32--4e-=3CO2+H2O.
点评 本题考查原电池和电解池原理、盖斯定律、燃烧热等知识点,侧重考查基本理论,注意不能根据金属的活泼性强弱判断正负极,要根据失电子难易程度判断正负极,为易错点.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
| A. | 1:1:1 | B. | 1:3:3 | C. | 4:4:5 | D. | 1:5:3 |
| A. | 常温常压下,2g 氢气所含原子数目为2NA | |
| B. | 36g H2O中含有的质子数为10NA | |
| C. | 标准状况下,11.2L水中含有的分子数是0.5NA | |
| D. | 1mol 氯气与足量水反应,转移的电子数是2NA |
| A. | 蒸馏 | B. | 分液 | C. | 过滤 | D. | 蒸发 |
| A. | 强电解质在溶液中完全电离,不存在电离平衡 | |
| B. | 纯净的强电解质在液态时,有的导电,有的不导电 | |
| C. | 同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同 | |
| D. | 在溶液中,导电能力强的电解质为强电解质,导电能力弱的电解质是弱电解质 |
| A. | 只能在高温下进行 | |
| B. | 只能在低温下进行 | |
| C. | 可能在高温下进行,也可能能在高温下进行 | |
| D. | 在高温或低温下均不能进行 |
| A. | CaCO3+2HCl═CaCl2+CO2↑+H2O | B. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O | ||
| C. | Fe2O3+6HCl═2FeCl3+3H2O | D. | NH4NO3 $\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O |
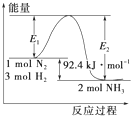 是可逆反应反应物不能完全转化.
是可逆反应反应物不能完全转化.