��Ŀ����
14��д�����з�Ӧ�����ӷ���ʽ����1����һС����Ͷ��ˮ��2Na+2H2O=2Na++2OH-+H2��
��2����ҵ�ϵ��ʳ��ˮ2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2��
��3��ϡ������Һ�м���������ƫ��������ҺAlO2-+4H+�TAl3++2H2O
��4����Ͷ������������Һ��2Al+2OH-+2H2O=2AlO2-+3H2��
��5������������Ũ����������MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
���� ��1������ˮ��Ӧ�����������ƣ�
��2����ⱥ��ʳ��ˮ�����������ƺ�������������
��3��ϡ������Һ�м���������ƫ��������Һ�����Ȼ�����ˮ���Ȼ��ƣ�
��4����Ͷ������������Һ������ƫ�����ƺ�������
��5������������Ũ���ᷴӦ�����Ȼ��̺�������ˮ��
��� �⣨1������ˮ��Ӧ�����������ƣ����ӷ���ʽ��2Na+2H2O=2Na++2OH-+H2����
�ʴ�Ϊ��2Na+2H2O=2Na++2OH-+H2����
��2����ⱥ��ʳ��ˮ�����������ƺ����������������ӷ���ʽ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2����
�ʴ�Ϊ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2����
��3��ϡ������Һ�м���������ƫ��������Һ�����Ȼ�����ˮ���Ȼ��ƣ����ӷ���ʽAlO2-+4H+�TAl3++2H2O��
�ʴ�Ϊ��AlO2-+4H+�TAl3++2H2O��
��4����Ͷ������������Һ������ƫ�����ƺ����������ӷ���ʽ��2Al+2OH-+2H2O=2AlO2-+3H2����
�ʴ�Ϊ��2Al+2OH-+2H2O=2AlO2-+3H2����
��5������������Ũ���ᷴӦ�����Ȼ��̺�������ˮ�����ӷ���ʽ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
�ʴ�Ϊ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
���� ���⿼�������ӷ���ʽ����д����ȷ��Ӧʵ���ǽ���ؼ�����Ŀ�ѶȲ���

| A�� | ����ͨ������ʱ�ж����ЧӦ | B�� | �������Ӵ���� | ||
| C�� | ������һ�ֽ����Եķ�ɢϵ | D�� | ��������ֱ����1-100nm֮�� |
| A�� | ������� | B�� | ǰ���Ǻ��ߵ�105�� | ||
| C�� | ������ǰ�ߵ�104�� | D�� | ���Ƚ� |
| A�� | ������п�����·���������� | |
| B�� | п���������������Ǹ��� | |
| C�� | ����ʱ����������ҺpH��С��������pH���� | |
| D�� | ��Һ��OH-�������ƶ���K+��H+���ƶ� |
| A�� | �ӵ��ξ��ǡ�I2+NaCl�� | B�� | �ӵ��ξ���NaCl�м���KI | ||
| C�� | �ӵ�����NaCl�м�������KIO3 | D�� | �ӵ��ξ��Ǵ�KIO3 |





 ��Dԭ�ӵ�ԭ�ӽṹʾ��ͼΪ
��Dԭ�ӵ�ԭ�ӽṹʾ��ͼΪ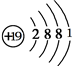 ��C+���ӵĽṹʾ��ͼΪ
��C+���ӵĽṹʾ��ͼΪ ��
��