题目内容
15.下列反应中,属于氧化还原反应的是( )| A. | CaCO3+2HCl═CaCl2+CO2↑+H2O | B. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O | ||
| C. | Fe2O3+6HCl═2FeCl3+3H2O | D. | NH4NO3 $\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O |
分析 含元素化合价变化的反应,为氧化还原反应,以此来解答.
解答 解:A、B、C中均不存在元素的化合价变化,均不属于氧化还原反应,
只有D中N元素的化合价变化,为氧化还原反应,
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析、应用能力的考查,题目难度不大.

练习册系列答案
相关题目
6.碘是公认的“智慧元素”,儿童缺碘会导致发育迟缓,成人缺碘会引起甲状腺肿大.因此我国强制推行食用加碘盐.下面是四位同学对食用加碘盐的有关认识,其中正确的是( )
| A. | 加碘盐就是“I2+NaCl” | B. | 加碘盐就是NaCl中加入KI | ||
| C. | 加碘盐是NaCl中加入少量KIO3 | D. | 加碘盐就是纯KIO3 |
10.为了使FeSO4氧化成Fe2(SO4)3而又不引入杂质,应向悬浊液中加入( )
| A. | Cl2 | B. | HNO3 | C. | H2O2 | D. | Na2O2 |
20.把钠放入滴有酚酞试液的水中,下列现象不会出现的是( )
| A. | 钠浮在水面上 | B. | 钠熔化成小球 | ||
| C. | 溶液中产生较多的气泡 | D. | 水溶液变成红色 |
7.相同物质的量的N2和CO两者相比较,下列说法不正确的是( )
| A. | 所占的体积一定相等 | B. | 所含原子总数相等 | ||
| C. | 所含电子总数相等 | D. | 所含分子数相等 |
4.下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明.请根据此表,结合化学和生物学科的知识,回答下列问题.
(1)要在食盐中加碘,是因为碘是人体内合成甲状腺激素的主要原料,缺碘会引起疾病.
(2)食盐中加碘,这碘指的是元素(填“单质”、“化合物”或“元素”),其中碘元素的化合价为+5.
(3)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易分解.
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
(2)食盐中加碘,这碘指的是元素(填“单质”、“化合物”或“元素”),其中碘元素的化合价为+5.
(3)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易分解.

 ,D原子的原子结构示意图为
,D原子的原子结构示意图为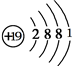 ,C+离子的结构示意图为
,C+离子的结构示意图为 .
.