题目内容
6.HClO是比H2CO3还弱的酸,为了提高氯水中HClO的浓度,可加入( )| A. | H2O | B. | CaO(s) | C. | CaCO3 (s) | D. | NaOH (s) |
分析 反应:Cl2+H2O?HCl+HClO达到平衡后,要使HClO浓度增加,应使平衡向正反应方向移动,HCl为强酸,HClO为弱酸,酸性比碳酸弱,以此解答该题.
解答 解:A.加入水,溶液体积增大,虽然平衡向正反应方向移动,但溶液浓度反而降低,故A错误;
B.加入CaO,盐酸和次氯酸都能够与其反应,次氯酸浓度降低,故B错误;
C.加入碳酸钙固体,HCl与碳酸钙反应,而HClO不反应,溶液中氢离子浓度减小,平衡向正反应方向移动,HClO浓度增加,故C正确;
D.NaOH和HCl、HCOl都反应,不能使HClO浓度增加,故D错误;
故选C.
点评 本题考查化学平衡的影响,题目难度不大,本题易错点为A,注意加入水,溶液体积增大的倍数要大于HClO物质的量增大的倍数,HClO浓度降低.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
17.世界年产量95%以上的H2O2由蒽醌氧化法生产.反应过程如下:
①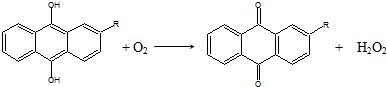
②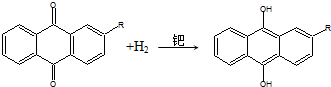
下列说法不正确的是( )
①

②
下列说法不正确的是( )
| A. | H2O2可用作漂白剂、消毒剂,也可作为火箭燃料 | |
| B. | H2O2可使湿润的KI淀粉试纸变蓝 | |
| C. | 蒽醌氧化法生产H2O2的实际结果是H2和O2生成H2O2 | |
| D. | H2O2化学性质稳定,便于储存和运输 |
14.某酸式盐NaHY的水溶液显碱性,下列叙述不正确的是( )
| A. | H2Y的电离方程式:H2Y?2H++Y2- | |
| B. | HY- 离子水解的离子方程式:HY-+H2O?H2Y+OH- | |
| C. | 该酸式盐溶液中离子浓度大小关系:c(Na+)>c(HY-)>c(OH-)>c(H+) | |
| D. | 该酸式盐溶液中离子浓度关系:c(H+)+c(H2Y)═c(OH-)+c(Y2-) |
11.乙烯和苯能够共同发生的反应类型有( )
①加成反应
②取代反应
③聚合反应
④氧化反应.
①加成反应
②取代反应
③聚合反应
④氧化反应.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
15.下列物质中,不能同时与强酸、强碱溶液反应的是( )
| A. | NaHSO4 | B. | Al2O3 | C. | NaHCO3 | D. | Al(OH)3 |
 在100mL由HCl、AlCl3、MgCl2组成的混合溶液中,滴加5mol/L的NaOH溶液,产生白色沉淀的质量与加入NaOH溶液的体积之间的关系如图所示.
在100mL由HCl、AlCl3、MgCl2组成的混合溶液中,滴加5mol/L的NaOH溶液,产生白色沉淀的质量与加入NaOH溶液的体积之间的关系如图所示.