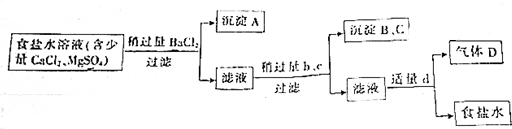
题目内容
9.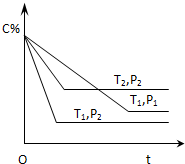 已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )| A. | T1>T2,P1>P2,m+n>x,Q>0 | B. | T1>T2,P1<P2,m+n<x,Q<0 | ||
| C. | T1>T2,P1<P2,m+n<x,Q>0 | D. | T1<T2,P1>P2,m+n>x,Q<0 |
分析 温度相同时,根据到达平衡的时间判断压强大小,再根据压强对C的含量的影响,判断压强对平衡的影响,确定反应气体气体体积变化情况;
压强相同时,根据到达平衡的时间判断温度大小,再根据温度对C的含量的影响,判断温度对平衡的影响,确定反应的热效应.
解答 解:由图象可知,温度为T1时,根据到达平衡的时间可知P2>P1,且压强越大,C的含量越低,说明压强增大平衡向逆反应方向移动,故正反应为气体体积增大的反应,即m+n<x;
压强为P2时,根据到达平衡的时间可知T1>T2,且温度越高,C的含量越低,说明温度升高平衡向逆反应方向移动,则正反应为放热反应,即Q<0,
故选B.
点评 本题考查化学平衡图象问题,难度不大,本题注意根据图象判断温度、压强的大小,根据温度、压强对平衡移动的影响分析.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
4.将浓度为0.1mol•L-1HF溶液加水不断稀释,下列说法正确的是( )
| A. | HF的电离平衡正向移动,c(H+)增大 | |
| B. | HF的电离程度增大,c(H+)、c(F-)增大、c(HF)减小,则$\frac{c({H}^{+})c({F}^{-})}{c(HF)}$增大 | |
| C. | 稀释过程中,c(OH-)、$\frac{c({H}^{+})}{c(HF)}$均增大 | |
| D. | 溶液的KW、$\frac{c({F}^{-})}{c({H}^{+})}$、pH均不变 |
14.在反应8NH3+3Cl2=6NH4Cl+N2中,若有10.2g NH3被氧化,则反应用去的氯气在标准状况下体积为( )
| A. | 5.04L | B. | 6.72L | C. | 20.16L | D. | 40.32L |
1.在容积可变的容器中发生的化学反应mA(g)+nB(g)?pC(s)+qD(g)在一定温度和不同压强下达到平衡时分别得到D物质的量浓度如下表所示:
根据表格中的数据,下列判断正确的是( )
| 压强/kPa | 2 | 5 | 10 | 12 |
| C(D)/mol•L- | 0.08 | 0.20 | 0.40 | 0.48 |
| A. | 当压强增大时平衡向左移动 | B. | m+n>q | ||
| C. | 增加压强,平衡常数增大 | D. | 平衡不随着压强的变化移动 |
19.下列关于原电池叙述不正确的是( )
| A. | 相对活泼的金属做负极 | B. | 原电池是把化学能转换为电能 | ||
| C. | 正极发生还原反应 | D. | 电流从正极经导线流向负极 |