题目内容
18.现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应过程用如图表示:
(1)写出下列物质的化学式XBa(NO3)2;
(2)写出步骤③涉及到的离子反应Ba2++CO32-═BaCO3↓,2Ag++CO32-═Ag2CO3↓;
(3)按此实验方案得到的溶液3中肯定含有杂质,为了解决这个问题,可以向溶液3中加入适量的HNO3(填化学式),之后若要获得固体NaNO3需进行的实验操作是蒸发结晶(填操作名称).
分析 如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3,以此解答该题.
解答 解:(1)如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,则试剂X为BaCl2[或Ba(NO3)2],沉淀A为BaSO4,沉淀B为AgCl,
故答案为:Ba(NO3)2;
(2)加入过量的BaCl2[或Ba(NO3)2],然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中含有Ag+、Ba2+,步骤③在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,反应的离子方程式为Ba2++CO32-═BaCO3↓、2Ag++CO32-═Ag2CO3↓,
故答案为:Ba2++CO32-═BaCO3↓;2Ag++CO32-═Ag2CO3↓;
(3)溶液3为NaNO3和Na2CO3的混合物,加入稀HNO3,可除去Na2CO3,最后加热蒸发、冷却结晶、过滤得到硝酸钠,
故答案为:HNO3;蒸发结晶.
点评 本题考查物质的分离提纯操作,题目难度中等,本题注意Cl-、SO42-的性质,把握除杂原则,提纯时不能引入新的杂质,注意把握实验的先后顺序.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
9.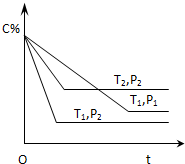 已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
 已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )| A. | T1>T2,P1>P2,m+n>x,Q>0 | B. | T1>T2,P1<P2,m+n<x,Q<0 | ||
| C. | T1>T2,P1<P2,m+n<x,Q>0 | D. | T1<T2,P1>P2,m+n>x,Q<0 |
6.下列有关化学用语表达正确的是( )
| A. | HCl的电子式: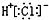 | B. | 氯离子(Cl-)的结构示意图: | ||
| C. | 乙酸的结构简式:C2H4O2 | D. | 质子数为17、中子数为20的氯原子: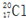 |
13.下列叙述中,正确的是( )
| A. | 标准状况下,Cl2的摩尔质量为71g | |
| B. | 氧化还原反应一定有氧元素参加 | |
| C. | 国际上规定,0.012kg 12C所含有的碳原子数约为1mol | |
| D. | Na2CO3属于钠盐,又属于碳酸盐是用交叉分类法分类的 |
3.下列说法正确的是( )
| A. | 绿色食品是指不含任何化学物质的食品 | |
| B. | 苯主要是从石油分馏而获得的一种重要化工原料 | |
| C. | 煤经气化和液化两个化学变化过程可以转变为清洁能源 | |
| D. | 乙烯和苯均能发生氧化反应,说明两者都有碳碳双键 |
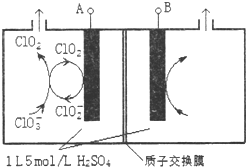 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
 .
.
 .
.