题目内容
1.在容积可变的容器中发生的化学反应mA(g)+nB(g)?pC(s)+qD(g)在一定温度和不同压强下达到平衡时分别得到D物质的量浓度如下表所示:| 压强/kPa | 2 | 5 | 10 | 12 |
| C(D)/mol•L- | 0.08 | 0.20 | 0.40 | 0.48 |
| A. | 当压强增大时平衡向左移动 | B. | m+n>q | ||
| C. | 增加压强,平衡常数增大 | D. | 平衡不随着压强的变化移动 |
分析 根据压强变化与浓度变化关系分析,当压强从2KPa增加到12KPa时,浓度增大倍数与压强的相等,则平衡不移动,据此分析.
解答 解:A、由表格数据可知当压强从2KPa增加到12KPa时,压强增大为原来的6倍,体积变为原来的$\frac{1}{6}$倍,浓度由0.08增大为0.48mol•L-1也增大为原来的6倍,所以压强从2KPa增加到12KPa时,平衡不移动,故A错误;
B、由表格数据可知当压强从2KPa增加到12KPa时,压强增大为原来的6倍,体积变为原来的$\frac{1}{6}$倍,浓度由0.08增大为0.48mol•L-1也增大为原来的6倍,所以压强从2KPa增加到12KPa时,平衡不移动,所以m+n=q,故B错误;
C、平衡常数只受温度影响,温度不变平衡常数不变,故C错误;
D、由表格数据可知当压强从2KPa增加到12KPa时,压强增大为原来的6倍,体积变为原来的$\frac{1}{6}$倍,浓度由0.08增大为0.48mol•L-1也增大为原来的6倍,所以压强从2KPa增加到12KPa时,平衡不移动,故D正确;
故选D.
点评 本题考查压强对化学平衡的影响,突出数据提取、分析处理数据能力,难度适中.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
19.28g铁与足量的盐酸完全反应时生成的氢气是( )
| A. | 0.5mol | B. | 1mol | C. | 1.5mol | D. | 2mol |
12.Mg(OH)2固体在水中存在下列溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),欲减少Mg(OH)2固体的量,可以加入少量的( )
| A. | NaOH固体 | B. | NaCl固体 | C. | MgSO4固体 | D. | NaHSO4固体 |
9.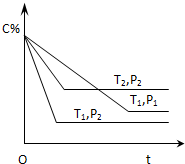 已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
 已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )| A. | T1>T2,P1>P2,m+n>x,Q>0 | B. | T1>T2,P1<P2,m+n<x,Q<0 | ||
| C. | T1>T2,P1<P2,m+n<x,Q>0 | D. | T1<T2,P1>P2,m+n>x,Q<0 |
6.下列有关化学用语表达正确的是( )
| A. | HCl的电子式: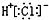 | B. | 氯离子(Cl-)的结构示意图: | ||
| C. | 乙酸的结构简式:C2H4O2 | D. | 质子数为17、中子数为20的氯原子: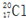 |
13.下列叙述中,正确的是( )
| A. | 标准状况下,Cl2的摩尔质量为71g | |
| B. | 氧化还原反应一定有氧元素参加 | |
| C. | 国际上规定,0.012kg 12C所含有的碳原子数约为1mol | |
| D. | Na2CO3属于钠盐,又属于碳酸盐是用交叉分类法分类的 |
11.根据下表部分短周期元素的原子半径及主要化合价信息回答以下问题:
(1)E与氢形成的化合物由两种分别是H2O、H2O2,其中心原子的杂化方式分别是sp3、sp3.
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Al(OH)3+3H+═Al3++3H2O.
(3)实验室中制取H单质反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
| 元素 | A | B | C | D | E | F | G | H |
| 原子半径(nm) | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Al(OH)3+3H+═Al3++3H2O.
(3)实验室中制取H单质反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
 、C和E形成的化合物
、C和E形成的化合物 、A、B和E形成的化合物
、A、B和E形成的化合物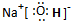 .
.
 .
.