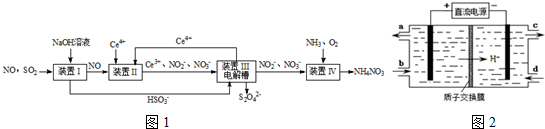
题目内容
14.在反应8NH3+3Cl2=6NH4Cl+N2中,若有10.2g NH3被氧化,则反应用去的氯气在标准状况下体积为( )| A. | 5.04L | B. | 6.72L | C. | 20.16L | D. | 40.32L |
分析 被氧化的氨气生成N2,根据原子守恒计算氮气的物质的量,再根据方程式计算氯气的物质的量,进而计算参加反应氯气的体积.
解答 解:10.2g氨气的物质的量=$\frac{10.2g}{17g/mol}$=0.6mol,氨气被氧化生成氮气,根据N原子守恒可知生成氮气的物质的量=$\frac{0.6mol}{2}$=0.3mol,由方程式8NH3+3Cl2═6NH4Cl+N2可知参加反应氯气为0.3mol×3=0.9mol,故参加反应氯气的体积=0.9mol×22.4L/mol=20.16L,
故选C.
点评 本题考查化学方程式的有关计算、氧化还原反应有关计算,难度不大,利用电子转移守恒计算氯气的物质的量更简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.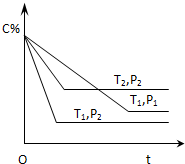 已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
 已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )| A. | T1>T2,P1>P2,m+n>x,Q>0 | B. | T1>T2,P1<P2,m+n<x,Q<0 | ||
| C. | T1>T2,P1<P2,m+n<x,Q>0 | D. | T1<T2,P1>P2,m+n>x,Q<0 |
6.下列有关化学用语表达正确的是( )
| A. | HCl的电子式: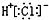 | B. | 氯离子(Cl-)的结构示意图: | ||
| C. | 乙酸的结构简式:C2H4O2 | D. | 质子数为17、中子数为20的氯原子: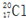 |
3.下列说法正确的是( )
| A. | 绿色食品是指不含任何化学物质的食品 | |
| B. | 苯主要是从石油分馏而获得的一种重要化工原料 | |
| C. | 煤经气化和液化两个化学变化过程可以转变为清洁能源 | |
| D. | 乙烯和苯均能发生氧化反应,说明两者都有碳碳双键 |
4.X、Y、Z、W四种金属单质①X、Y形成的原电池中,X做负极;②Z、W形成的原电池中Z附近有气泡;③Y、W分别与稀盐酸反应,Y反应较快,则四种金属活泼性由强到弱的顺序是( )
| A. | X、Y、W、Z | B. | X、Y、Z、W | C. | W、Z、X、Y | D. | Z、W、X、Y |