题目内容
《化学与技术》模块
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
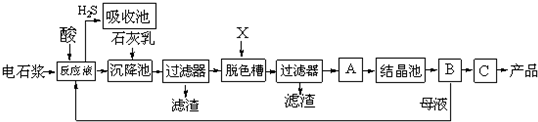
已知氯化钙晶体化学式是:CaCl2?6H2O,H2S是一种酸性气体,具有还原性.
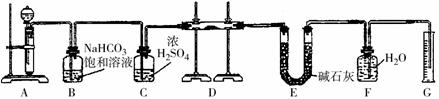
(1)反应器中加入的酸应选用______.
(2)脱色槽中应加入的物质X是______;设备A的作用是______;设备B的名称是______;设备C的作用是______.
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是______.
A.水 B.浓硫酸 C.石灰乳 D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是______.
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其它不溶于酸的物质 |
| 质量分数(%) | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23~26 |

已知氯化钙晶体化学式是:CaCl2?6H2O,H2S是一种酸性气体,具有还原性.
(1)反应器中加入的酸应选用______.
(2)脱色槽中应加入的物质X是______;设备A的作用是______;设备B的名称是______;设备C的作用是______.
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是______.
A.水 B.浓硫酸 C.石灰乳 D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是______.
(1)因要生产CaCl2,过程中不引入新的杂化离子,所以应选用盐酸,
故答案为:盐酸;
(2)活性炭具有吸附性,可以进行溶液脱水.A池后面接的是结晶池,故A应为蒸发浓缩;从B中有母液出来,故B为过滤器.B中得到晶体,所以需要脱水干燥,才能得到CaCl2产品,
故答案为:活性炭;蒸发浓缩;过滤器;脱水干燥;
(3)H2S为酸性气体,应用碱液吸收,故选石灰乳,
故答案为:C;
(4)设备B中产生的母液含有氯化物,回收利用,可以降低废弃物排放量,提高经济效益,
故答案为:对母液回收利用,降低废弃物排放量,提高经济效益.
故答案为:盐酸;
(2)活性炭具有吸附性,可以进行溶液脱水.A池后面接的是结晶池,故A应为蒸发浓缩;从B中有母液出来,故B为过滤器.B中得到晶体,所以需要脱水干燥,才能得到CaCl2产品,
故答案为:活性炭;蒸发浓缩;过滤器;脱水干燥;
(3)H2S为酸性气体,应用碱液吸收,故选石灰乳,
故答案为:C;
(4)设备B中产生的母液含有氯化物,回收利用,可以降低废弃物排放量,提高经济效益,
故答案为:对母液回收利用,降低废弃物排放量,提高经济效益.

练习册系列答案
相关题目