题目内容
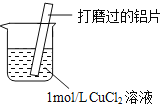
【题目】某小组同学在实验室研究Al与CuCl2溶液的反应.
实验操作 | 实验现象 |
|
|
(1)现象![]() 中的红色物质是 ______ .
中的红色物质是 ______ .
(2)经检验现象![]() 中的无色气体为氢气.
中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因 ______.
②氢气从红色物质表面逸出的原因是 ______ .
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液![]()
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是 ______.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因 ______.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有 ______性.
②取Cu粉与1mol/LCuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是 ______ .
【答案】Cu ![]() ; Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气 加入足量的稀硝酸,再滴加几滴硝酸银溶液 CuCl在水溶液中存在平衡:
; Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气 加入足量的稀硝酸,再滴加几滴硝酸银溶液 CuCl在水溶液中存在平衡:![]() ,加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解 还原 加热
,加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解 还原 加热
【解析】
(1)在金属活动顺序表中,排在前面的金属能从盐溶液中置换出后面的金属,铝和硫酸铜溶液发生置换反应生成铜;
(2)①氯化铜是强酸弱碱盐水解溶液显酸性;
②氯置换出铜附着在铝表面在电解质溶液中形成原电池反应,铜做负极,溶液中氢离子在铜电极发生还原反应生成氢气;
(3)①依据实验步骤可知步骤d是验证Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色,所以步骤c是验证白色沉淀可能是CuCl,检验反应后的溶液中是否含氯离子;
②氯化亚铜白色沉淀在水溶液中存在沉淀溶解平衡,加入浓氨水会和亚铜离子形成Cu(NH3)2+(无色),平衡正向进行促进沉淀溶解;
(4)①若是Cu与CuCl2溶液反应生成了CuCl,元素化合价分析可知铜化合价0价变化为![]() 价,元素化合价升高失电子做还原剂发生氧化反应;
价,元素化合价升高失电子做还原剂发生氧化反应;
②铝和氯化铜溶液反应过程中有白色沉淀生成,反应过程非常大量热量,证明了Cu与CuCl2溶液反应生成CuCl,可以加热观察是否生成白色沉淀.
(1)铝的活泼些大于铜,和硫酸铜溶液发生置换反应生成铜,铝表面析出红色的铜;
(2)①氯化铜是强酸弱碱盐水解溶液显酸性,![]() ,溶液中存在大量H+的原因是因为水解生成的,反应的离子方程式为:
,溶液中存在大量H+的原因是因为水解生成的,反应的离子方程式为:![]() ;
;
②氯置换出铜附着在铝表面在电解质溶液中形成原电池反应,铜做负极,溶液中氢离子在铜电极发生还原反应生成氢气,电极反应为![]() ;
;
(3)①依据实验步骤可知步骤d是验证Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色,所以步骤c是验证白色沉淀可能是CuCl,检验反应后的溶液中是否含氯离子,步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液,观察是否生成白色沉淀判断氯离子的存在;
②氯化亚铜白色沉淀在水溶液中存在沉淀溶解平衡,加入浓氨水会和亚铜离子形成Cu(NH3)2+(无色),平衡正向进行促进沉淀溶解,用化学平衡移动原理解释CuCl溶于浓氨水的原因是:CuCl在水溶液中存在平衡:![]() ,加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解;
,加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解;
(4)①若是Cu与CuCl2溶液反应生成了CuCl,元素化合价分析可知铜化合价0价变化为![]() 价,元素化合价升高失电子做还原剂发生氧化反应,铜表现的是还原性;
价,元素化合价升高失电子做还原剂发生氧化反应,铜表现的是还原性;
②铝和氯化铜溶液反应过程中有白色沉淀生成,反应过程非常大量热量,证明了Cu与CuCl2溶液反应生成CuCl,可以加热观察是否生成白色沉淀,若加热出现沉淀说明Cu与CuCl2溶液反应生成了CuCl,若不出现沉淀说明Cu与CuCl2溶液不能反应生成了CuCl。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案