题目内容
18.(1)某有机物A含有C、H、O三种元素,其蒸气密度是相同条件下H2密度的29倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1.有机物A的分子式C3H6O,该有机物的红外光谱显示该分子中有一个羟基,无甲基的链状结构,请写出A的结构简式CH2=CHCH2OH.(2)单官能团化合物A的相对分子质量不超过100,完全燃烧只生成CO2和H2O;A中碳、氢元素的质量分数之和为47.63%.A的分子式是C3H8O3,其结构简式是
 .
.
分析 (1))有机物A的相对分子质量=29×2=58,1.16g有机物A的物质的量=1.16g÷58g/mol=0.02mol,设1.16g有机物A燃烧生成CO2的为xmol,则H2O的也为xmol,故44x+18x=3.72,解得:x=0.06,然后根据质量守恒定律确定其分子式;该有机物分子有一个羟基,无甲基的链状结构,据此确定其结构简式;
(2)单官能团化合物A的相对分子质量不超过100,完全燃烧只生成CO2和H2O;A中碳、氢元素的质量分数之和为47.63%,假设相对分子质量为100,则含O为$\frac{100×52.37%}{16}$≈3,含C为$\frac{100×47.63%}{12}$≈3,含单一官能团为-OH,应为醇.
解答 解:(1)有机物A的相对分子质量=29×2=58,1.16g有机物A的物质的量=1.16g÷58g/mol=0.02mol,设1.16g有机物A燃烧生成CO2的为xmol,则H2O的也为xmol,故44x+18x=3.72,解得:x=0.06,故有机物分子C原子数目 $\frac{0.06mol}{0.02mol}$=3、H原子数目为 $\frac{0.06mol×2}{0.02mol}$=6、O原子数目=$\frac{58-12×3-6}{16}$=1,则有机物分子式为C3H6O;
该有机物的分子式为C3H6O,分子有一个羟基,无甲基的链状结构,故有机物A的结构简式为:CH2=CHCH2OH,
故答案为:C3H6O;CH2=CHCH2OH;
(2)单官能团化合物A的相对分子质量不超过100,完全燃烧只生成CO2和H2O;A中碳、氢元素的质量分数之和为47.63%,假设相对分子质量为100,则含O为O为$\frac{100×52.37%}{16}$≈3,含C为$\frac{100×47.63%}{12}$≈3…8,含单一官能团为-OH,应为醇,分子式应为:C3H8O3,结构简式为: ,
,
故答案为:C3H8O3; .
.
点评 本题考查有机物化分子式确定及合成,关键根据燃烧法确定有机物分子组成,是高考中的常见题目,题目难度中等,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

 的键线式可写作
的键线式可写作 ,某有机物的键线式为
,某有机物的键线式为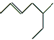 ,其正确名称是( )
,其正确名称是( )| A. | 5-乙基-2-己烯 | B. | 2-甲基庚烯 | C. | 3-甲基-5-庚烯 | D. | 5-甲基-2-庚烯 |
| A. | 能发生加聚反应生成高分子化合物 | B. | 该物质与HCl加成产物只一种 | ||
| C. | 具有多种同分异构体 | D. | 可与强酸反应 |
| A. | NaOH | B. | CO2 | C. | C | D. | SiO2 |
| 中心原子杂化方式 | 分子空间构型 | |
| NH3 | sp3 | 三角锥形 |
| BF3 | sp2 | 平面正三角形 |
| H2O | sp3 | V形 |
| A. | 原子半径大小:Na>S>O | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 还原性强弱:Cl-<Br-<I- | D. | 碱性强弱:KOH>NaOH>LiOH |
