题目内容
6.锰锌铁氧体(ZnaMnbFecO4,Fe元素为+3价,Zn、Mn元素化合价相同)是一种重要的磁性材料.测定铁氧体中ZnO的实验步骤如下:
(1)a、b、c的代数关系式为2a+2b+3c=8.
(2)“除锰”时发生反应的离子方程式为Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+.
(3)配制溶液A用的玻璃仪器有250mL容量瓶、烧杯、玻璃棒及胶头滴管.
(4)准确量取25.00mL溶液A,二甲酚橙作指示剂,用0.01000mol•L-1的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+(反应原理为Zn2++H2Y2-=ZnY2-+2H+),至滴定终点时消耗EDTA 标准溶液20.00mL.通过计算确定该铁氧体中ZnO的质量分数(写出计算过程)16.2%.
分析 锰锌铁氧体(ZnaMnbFecO4,Fe元素为+3价,Zn、Mn元素化合价相同)加盐酸溶解,再加(NH4)2S2O8把锰离子氧化为二氧化锰,过滤,滤液中含有铁离子和锌离子,加NaF和缓冲溶液掩蔽铁,最后测定锌;
(1)ZnaMnbFecO4,Fe元素为+3价,Zn为+2价,Zn、Mn元素化合价相同,根据化合价的代数和为零计算;
(2)(NH4)2S2O8把锰离子氧化为二氧化锰,同时生成硫酸根离子;
(3)根据配制250mL溶液的步骤分析;
(4)根据Zn2++H2Y2-=ZnY2-+2H+,由消耗的标准溶液的物质的量计算Zn2+的物质的量,再求出250mL溶液中Zn2+的物质的量和质量,然后求出铁氧体中ZnO的质量分数.
解答 解:锰锌铁氧体(ZnaMnbFecO4,Fe元素为+3价,Zn、Mn元素化合价相同)加盐酸溶解,再加(NH4)2S2O8把锰离子氧化为二氧化锰,过滤,滤液中含有铁离子和锌离子,加NaF和缓冲溶液掩蔽铁,最后测定锌;
(1)ZnaMnbFecO4,Fe元素为+3价,Zn为+2价,Zn、Mn元素化合价相同,则2a+2b+3c+(-2)×4=0,则2a+2b+3c=8,
故答案为:2a+2b+3c=8;
(2)(NH4)2S2O8把锰离子氧化为二氧化锰,同时生成硫酸根离子,其反应的离子方程式为:Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+;
故答案为:Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+;
(3)配制250mL溶液,先在烧杯中溶解药品,用玻璃棒搅拌,转移到250mL容量瓶,定容,故答案为:250mL容量瓶;
(4)由Zn2++H2Y2-=ZnY2-+2H+,可知Zn2+的物质的量n(Zn2+)=n(H2Y2-)=0.01000mol•L-1×0.0200L,
则250mL溶液中Zn2+的物质的量为n(Zn2+)=0.01000mol•L-1×0.0200L×$\frac{250mL}{25mL}$,
则ZnO的质量为0.01000mol•L-1×0.0200L×$\frac{250mL}{25mL}$×81g/mol=0.162g,
所以该铁氧体中ZnO的质量分数$\frac{0.162g}{1.000g}$×100%=16.2%;
故答案为:16.2%.
点评 本题以工业流程图为依托,考查了化学式的计算、离子方程式的书写、溶液的配制等,题目难度中等,解题关键是合理分析题中流程及准确把握物质的性质,试题培养了学生分析、理解能力及灵活应用所学知识的能力.

| A. | 将甲烷和乙烯的混合气体通过酸性高锰酸钾溶液,可除去乙烯 | |
| B. | 配制银氨溶液:在一定量AgNO3溶液中,逐滴滴加稀氨水至沉淀恰好溶解为止 | |
| C. | 验证RX为碘代烷,把RX与烧碱水溶液混合加热,将溶液冷却后再加入硝酸银溶液 | |
| D. | 无水乙醇和浓硫酸共热至170℃,将制得的气体通入酸性高锰酸钾可检验制得的气体是否为乙烯 |
| A. | BF3 | B. | CCl4 | C. | H2O | D. | PCl5 |
| A. |  如图装置可用于制备乙酸乙酯 | |
| B. |  如图装置可用于模拟海水蒸馏 | |
| C. |  如图装置可用于探究碳酸氢钠的热稳定性 | |
| D. |  如图装置为配制溶液过程中的定容操作 |
| A. | 可吸入颗粒 | B. | 氮气 | C. | 氧气 | D. | 二氧化碳 |
| A. | 控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 | |
| B. | CO2、NO2或SO2都会导致酸雨的形成 | |
| C. | 硅是一种灰黑色的金属单质,是现代信息产业的重要元素 | |
| D. | 白磷着火点高且无毒,可用于制造安全火柴 |
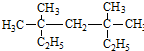 系统命名为3,3,5,5-四甲基庚烷;
系统命名为3,3,5,5-四甲基庚烷;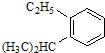 的芳香炔烃的结构简式
的芳香炔烃的结构简式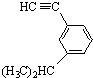 ;
;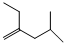 .
.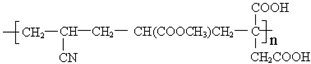
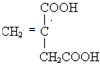 ;
; .
. .
.