题目内容
4.已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
回答下列问题:
(1)写出A的电子式
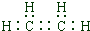 .
.(2)B、D分子中的官能团名称分别是羟基、羧基.
(3)写出下列反应的化学方程式及反应类型:
①CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,属于加成反应;
②2 CH3CH2OH+O2$→_{△}^{Cu}$2 CH3CHO+2H2O,属于氧化反应;
④CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O,属于取代反应.
CH3COOCH2CH3+H2O,属于取代反应.
分析 A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应得到B为CH3CH2OH,B能氧化得到C为CH3CHO,C氧化得到D为CH3COOH,乙醇与乙酸发生酯化反应得到乙酸乙酯,据此解答.
解答 解:A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应得到B为CH3CH2OH,B能氧化得到C为CH3CHO,C氧化得到D为CH3COOH,乙醇与乙酸发生酯化反应得到乙酸乙酯,
(1)由上述分析可知,A的结构简式为CH2=CH2,电子式为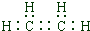 ,故答案为:
,故答案为: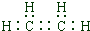 ;
;
(2)B为为CH3CH2OH,含有官能团为羟基,D为CH3COOH,官能团名称是羧基,故答案为:羟基;羧基;
(3)反应①的化学方程式为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,属于加成反应;
反应②的化学方程式为:2 CH3CH2OH+O2$→_{△}^{Cu}$2 CH3CHO+2H2O,属于氧化反应;
反应④的化学方程式为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,属于取代反应,
CH3COOCH2CH3+H2O,属于取代反应,
故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,加成;
2 CH3CH2OH+O2$→_{△}^{Cu}$2 CH3CHO+2H2O,氧化;
CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,取代.
CH3COOCH2CH3+H2O,取代.
点评 本题考查无机物推断,涉及烯烃、醇、醛、羧酸的性质与转化,比较基础,侧重对基础知识的巩固.

练习册系列答案
相关题目
15.化学上通常把原子数和电子数相等的分子或离子称为等电子体,人们发现等电子体间的结构和性质相似(即等电子原理),B3N3H6被称为无机苯,它与苯是等电子体,则下列说法中不正确的是( )
| A. | 无机苯分子中只含有极性键 | |
| B. | 无机苯能发生加成反应和取代反应 | |
| C. | 无机苯的二氯取代物有3种同分异构体 | |
| D. | 无机苯不能使KMnO4酸性溶液褪色 |
12.下列叙述正确的是( )
| A. | 氧的摩尔质量为32 g/mol | |
| B. | 1 mol CO32-的质量为60 g/mol | |
| C. | H2SO4的摩尔质量等于H2SO4的相对分子质量 | |
| D. | 1 mol CO2的质量与CO2的相对分子质量在数值上相同 |
19.下列物质既能与盐酸反应又能与NaOH反应的是( )
①Fe;②Al;③Al2O3;④Fe2O3;⑤Al(OH)3;⑥Fe(OH)2;⑦Fe(OH)3.
①Fe;②Al;③Al2O3;④Fe2O3;⑤Al(OH)3;⑥Fe(OH)2;⑦Fe(OH)3.
| A. | ②③⑤ | B. | ②③⑤⑥ | C. | ②③④⑤ | D. | ①②③④⑤ |
16.下列说法正确的是( )
| A. | 制HF用烧瓶作反应容器 | B. | 用KI与浓硫酸反应制HI | ||
| C. | 制乙炔时不能用启普发生器 | D. | 用CuS与硫酸反应制H2S |
13.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ar,只有负价而无正价的元素是F,可用于制半导体材料的元素是Si
(2)C元素在元素周期表中的位置是三周期ⅢA族.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(4)A分别与E、G、H形成的化合物中,最稳定的HF;
(5)在B、C、E、F中,原子半径最大的是Na.
(6)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(7)B、H两种元素形成的化合物所含的化学键类型为离子键
(8)写出C的最高价氧化物与H的氢化物之间反应的离子方程式Al2O3++6H+=2Al3++3H2O.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)C元素在元素周期表中的位置是三周期ⅢA族.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(4)A分别与E、G、H形成的化合物中,最稳定的HF;
(5)在B、C、E、F中,原子半径最大的是Na.
(6)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(7)B、H两种元素形成的化合物所含的化学键类型为离子键
(8)写出C的最高价氧化物与H的氢化物之间反应的离子方程式Al2O3++6H+=2Al3++3H2O.
14.下列表示对应化学反应的离子方程式正确的是( )
| A. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 向FeI2溶液中通入足量的氯气:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 少量硫酸氢钠溶液和氢氧化钡溶液混合:Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O | |
| D. | 硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I-═Fe2++5I2+3NO↑+6H2O |
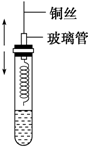 某同学在学习了乙醇的知识后,设计了如图所示的实验.操作步骤及观察到的现象如图:
某同学在学习了乙醇的知识后,设计了如图所示的实验.操作步骤及观察到的现象如图: 实验课上配制500mL 0.5mol/L的NaOH溶液,试回答下列问题.
实验课上配制500mL 0.5mol/L的NaOH溶液,试回答下列问题.