��Ŀ����
11��FeCl3���ִ���ҵ������Ӧ�ù㷺��ij��ѧ�о���ѧϰС��ģ�ҵ���������Ʊ���ˮFeCl3�����ø���ƷFeCl3��Һ�����ж���H2S��I�����������ϵ�֪����ˮFeCl3�ڿ������׳��⣬����������������������Ʊ���ˮFeCl3��ʵ�鷽����װ��ʾ��ͼ�����ȼ��г�װ����ȥ���������������£�
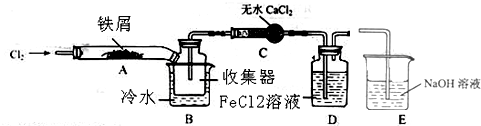
�ټ��װ�õ������ԣ�
��ͨ������Cl2���Ͼ�װ���еĿ�����
���þƾ�������м�·���������Ӧ���
�ܡ�
����ϵ��ȴ��ֹͣͨ��Cl2�����ø����N2�Ͼ�Cl2�����ռ����ܷ�
��ش��������⣺
��1��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ2Fe+3Cl2$\frac{\underline{\;\;��\;\;}}{\;}$2FeCl3��
��2���ڢ۲����Ⱥ����ɵ���״FeCl3�ֽ����ռ��������������ڷ�Ӧ��A�Ҷ�Ҫʹ������FeCl3�����ռ������ڢܲ��������ڳ�����FeCl3�����·����ȣ�
��3���������������У�Ϊ��ֹFeCl3��������ȡ�Ĵ�ʩ�У������ţ��ڡ��ݣ�
��4��װ��D��FeCl2ȫ����Ӧ����ʧȥ����Cl2�����ö�ʧЧ��д������FeCl2�Ƿ�ʧЧ���Լ������Ը��������Һ��
����ͬѧ��װ��D�еĸ���ƷFeCl3��Һ����H2S���õ��������˺�����ʯīΪ�缫����һ�������µ����Һ��
��5��FeCl3��H2S��Ӧ�����ӷ���ʽΪ2Fe3++H2S=2Fe2++S��+2H+��
��6��������H+�������ŵ����H2�������ĵ缫��ӦʽΪFe2+-e-=Fe3+��
��7���ۺϷ���ʵ����������Ӧ����֪��ʵ�������������ŵ㣺��H2S��ԭ��������Ϊ100%����FeCl3����ѭ�����ã�
���� ��װ��A������������Ӧ����ӦΪ��2Fe+3Cl2 $\frac{\underline{\;\;��\;\;}}{\;}$2FeCl3��B�е���ˮ����Ϊ����ȴFeCl3ʹ������������ռ���Ʒ��Ϊ��ֹ�������е�ˮ��������װ��ʹFeCl3���⣬������װ��C��ˮ�Ȼ�������ˮ��װ��D����FeCl2����Cl2ʱ�ķ�Ӧ���ӷ���ʽ2Fe2++Cl2�T2Fe3++2Cl-����װ��D�еĸ���ƷFeCl3��Һ����H2S�����ӷ���ʽΪ��2Fe3++H2S=2Fe2++S��+2H+��������������Һ���յ���������
��1��װ��A������������Ӧ�����Ȼ�����
��2��Ҫʹ������FeCl3�����ռ���������FeCl3���������������ʣ�
��3����ֹFeCl3���⣬����ˮ�����Ӵ���
��4������FeCl2�Ƿ�ʧЧ��Ӧ����FeCl2�Ƿ���ڣ�������KMnO4��Һ���飻
��5�����������������ԣ�������л�ԭ�ԣ�����֮�䷢��������ԭ��Ӧ��
��6������Ȼ�����ʱ�����������ӵõ����ӷ�����ԭ��Ӧ������������ʧȥ���ӷ���������Ӧ��
��7������FeCl3����ѭ�����÷�����
��� �⣺I����1����������ǿ�����ԣ��ܽ���۵Ľ��������ɸ۵Ľ�����װ��A������������Ӧ�����Ȼ�������ӦΪ��2Fe+3Cl2$\frac{\underline{\;\;��\;\;}}{\;}$2FeCl3��
�ʴ�Ϊ��2Fe+3Cl2$\frac{\underline{\;\;��\;\;}}{\;}$2FeCl3��
��2���ڢ۲����Ⱥ����ɵ���״FeCl3�ֽ����ռ������ڢܲ������Ƕ�FeCl3���ȷ�������ʹ������FeCl3�����ռ�����
�ʴ�Ϊ���ڳ�����FeCl3�����·����ȣ�
��3��Ϊ��ֹFeCl3��������ȡ�Ĵ�ʩ�Т�ͨ������Cl2���ø����N2�Ͼ�Cl2��
�ʴ�Ϊ���ڢݣ�
��4������FeCl2�Ƿ�ʧЧ���Ǽ�������Fe2+�������Ǽ���Fe3+�Ĵ��ڣ�����ѡ��KSCN��Һ����Ӧ��ѡ��KMnO4��Һ����Fe2+�л�ԭ����ʹ���Ը��������Һ��ɫ��
�ʴ�Ϊ�����Ը��������Һ��
��5�����������������ԣ�������л�ԭ�ԣ�����֮�䷢��������ԭ��Ӧ��2FeCl3+3H2S=2FeCl2+6HCl+3S�������ӷ���ʽΪ��2Fe3++H2S=2Fe2++S��+2H+��
�ʴ�Ϊ��2Fe3++H2S=2Fe2++S��+2H+��
��6������Ȼ�����ʱ���������������ӵõ��ӵĻ�ԭ��Ӧ��2H++2e-�TH 2���������������ӷ���ʧ���ӵ�������Ӧ��Fe2+-e-=Fe3+��
�ʴ�Ϊ��Fe2+-e-=Fe3+��
��7�����������յõ���FeCl3��������������H2S���õ�ѭ�����ã�
�ʴ�Ϊ��FeCl3����ѭ�����ã�
���� ���⿼�����Ʊ���ˮFeCl3ʵ�������ʵ����ƣ���Ŀ�Ѷ��еȣ����ؿ��������ȡ����仯���������Ӧ�á�ʵ����������ķ����жϡ�ʵ��������ƶϺ�Ӧ�ã������ۺ��Խ�ǿ������������ѧ�����Ӧ�û���֪ʶ��������

 ���ݼ���ϵ�д�
���ݼ���ϵ�д������ʵ�鲽�裬�ش��������⣺����֪��NaBr+H2SO4$\frac{\underline{\;\;��\;\;}}{\;}$NaHSO4+HBr��
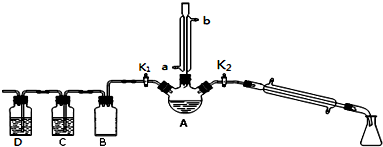
��1���ر�K1��K2����ͨ��ֱ�����ܵ�����ˮ����A����30���ӣ��Ʊ�1-�嶡�飮��ֱ�����ܵ����� ������������ʹ��ˮ��a����a��b�������룮
��2��д��A�з�����Ӧ����Ҫ��ѧ����ʽ��NaBr+H2SO4�THBr+NaHSO4��HBr+CH3CH2OH$\stackrel{��}{��}$CH3CH2Br+H2O
��3�������ϣ�������Ӧ�������ﻹ�����У����ѡ�1-��ϩ���廯�⡢�������ơ�ˮ�ȣ�Ϩ��A���� ���ƣ�����ֱ�������Ϸ��������ӡ���K1���������ȼ�����Ӧֱ����ȴ��ͨ��C��Dװ�ü���
���ָ����C��D��Ӧʢ�ŵ��Լ��ֱ��������������������Һ����ˮ��
�۲쵽Dƿ�е���������Һ��ɫ
��4������л�����������£�
| ���� | �۵�/�� | �е�/�� |
| 1-���� | -89.5 | 117.3 |
| 1-�嶡�� | -112.4 | 101.6 |
| ���� | -95.3 | 142.4 |
| 1-��ϩ | -185.3 | -6.5 |
 ��֪�������ݣ�
��֪�������ݣ�| ���� | �۵㣨�棩 | �е㣨�棩 | �ܶȣ�g•cm-3�� |
| �Ҵ� | -117.0 | 78.0 | 0.79 |
| ���� | 16.6 | 117.9 | 1.05 |
| �������� | -83.6 | 77.5 | 0.90 |
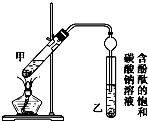
������2mLŨ���ᡢ3mL�Ҵ�����18O����2mL����Ļ����Һ��
�ڰ���ͼ��ʾ���Ӻ�װ�ã�װ�����������ã���������Һ����С����ȼ���3��5min��
�۴��Թ����ռ���һ���������ֹͣ���ȣ������Թ��Ҳ�������Ȼ���÷ֲ㣮
�ܷ��������������ϴ�ӡ����
��1�����Ƣ��л����Һ�ķ���ΪӦ�ȼ����Ҵ���Ȼ���ҡ���Թܱ���������Ũ���ᣬ����������
��Ӧ��Ũ����������Ǵ��� ��ˮ����д����ȡ���������Ļ�ѧ����ʽ��CH3COOH+C2H5OH$?_{��}^{ŨH_{2}SO_{4}}$CH3COOC2H5+H2O��
��2������ʵ���б���̼������Һ��������BC������ĸ����
A���к�������Ҵ� B���к����Ტ�����Ҵ� C�����������������ܽ� D�������������ɣ���������
��3�����������ҪС����ȼ��ȣ�����Ҫ�����Ǽ��������Ҵ��Ļӷ������ٸ���Ӧ�ķ�������������۲쵽���������Թ����е�Һ��ֳ��������㣬�ϲ���ɫ���²�Ϊ��ɫҺ�壬���²�Һ��ĺ�ɫ��dz��
�������Թ��е����ʷ����Եõ���������������ʹ�õ������з�Һ©��������ʱ����������Ӧ�������Ͽڵ�����¿ڷš����Ͽڵ���������
��4����ͬѧ����ʵ�飬�ó��Ҵ�������������͵õ����������������������
| ʵ�� | �Ҵ���mL�� | ���ᣨmL�� | ����������mL�� |
| �� | 2 | 2 | 1.33 |
| �� | 3 | 2 | 1.57 |
| �� | 4 | 2 | x |
| �� | 5 | 2 | 1.76 |
| �� | 2 | 3 | 1.55 |
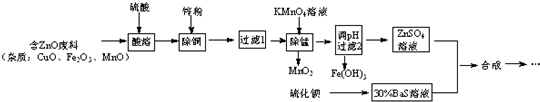
��1������30%BaS��Һ��������Ͳ���ձ�������������ȱ�ٵ�ʵ��������������ƽ��
��2������п�۱���ԭ��������Fe3+��Cu2+��
��3���������������£�KMnO4��Mn2+ʱ���������ӷ�Ӧ��2MnO4-+3Mn2++2H2O=5MnO2��+4H+��
��4��������ZnSO4���Խ�ǿ���ɲ�ȡ�ļ�ʩ�Ǽ�������п�ۣ�����ֱ���ܽ⣮
��5��������Һ�ϳ����·ۣ�����Ҫ�����»������ˡ�ϴ�ӡ�������ա�ĥ�۵ó�Ʒ��
��6������������·۳�Ʒ�Ȳ����������ԭ����Cu2+��Mn2+��Fe3+û�г�����
��7��ij�о���ѧϰС�����ӷϵ��пƬ ����Ҫ�ɷ�ΪZn��Fe��C�����������Ʊ�����������п��Һ���ٺϳ����·ۣ��벹�������ɷ�пƬ�Ʊ�ZnSO4��Һ��ʵ�鲽��[����г��˼������������������������pH����ʼ������pH����������Ũ��Ϊ1.0mol•L-1���㣩]��
| ��ʼ������pH | ������ȫ��pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
ʵ�鲽������Ϊ��
�����Թ���3.0 mol•L-1 H2SO4�ܽ��пƤ��
�ڼ�������30% H2O2��ʹ���ַ�Ӧ��
��1.0 mol•L-1 NaOH��������ҺpHԼΪ5����3.2��pH��5.9����ʹFe3+������ȫ��
�ܹ��˵���Һ��
 �ü���Ͷ�����̼�����Ʊ�����ԭ�ϣ�
�ü���Ͷ�����̼�����Ʊ�����ԭ�ϣ���1��һ���¶��£����ݻ���Ϊ2L���ܱ�������ͨ��3mol CO2��3mol CH4���������·�Ӧ��
CO2��g��+CH4��g��?2CO��g��+2H2��g��
��Ӧ��2minĩ�ﵽƽ��״̬����ʱ���CO2��CO�����������ȣ���ش��������⣺
��2min�ڣ���H2����ʾ�ķ�Ӧ����v��H2��=0.5mol/��L•min����
�ڴ��¶��¸÷�Ӧ��ƽ�ⳣ��K=1��
����������������Ϊ�÷�Ӧ�ﵽƽ��״̬�ı�־����BC������ѡ����ĸ��
A��v����CH4��=v����H2��
B��������ѹǿ���ֺ㶨����
C����Ӧ�ж���2mol C-H��ͬʱ����1mol H2
D�������ڻ��������ܶȱ��ֺ㶨����
����֪��
| ���� | H2 | CO | CH4 | CH3COOH |
| ȼ���ȣ�kJ/mol�� | 286 | 283 | 890 | 874 |
��Ϊ���CH4��ת���ʣ����Բ�ȡ�Ĵ�ʩ�Ǽ�С��Ӧѹǿ������CO2��Ũ�ȣ���д���㣩
��2���ڴ������£�����Ͷ�����̼������ֱ��ת�������ᣮ
���ڲ�ͬ�¶������������������ͼ��ʾ��
��250-400�淶Χ�ڣ�����������������¶ȱ仯��ԭ�����¶ȳ���250��ʱ�������Ĵ�Ч�ʽ��ͣ�
��250����400��ʱ������������������������ж�ʵ������ѡ�������¶���250�森
��1��Cl2+2KI=2KCl+I2��
��2��2FeCl2+Cl2=2FeCl3��
��3��2FeCl3+2HI=2FeCl2+2HCl+I2��
��4��H2S+I2=S+2HI��
| A�� | S��I2��Fe3+��Cl2 | B�� | Cl2��Fe3+��I2��S | C�� | Fe3+��Cl2��S��I2 | D�� | Cl2��I2��Fe3+��S |
�ٽ��ʯ�롰����ϩ��C60
��D��T
��16O��17O��18O
��������O2���������O3��
��CH4��CH3CH2CH3
���Ҵ���CH3CH2OH���ͼ��ѣ�CH3OCH3��
��
 ��
��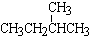
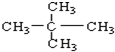
��
 ��
��
| A�� | �٢� | B�� | �ݢ� | C�� | �ޢ� | D�� | �ڢ� |
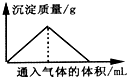
| A�� | ��Ư����Һ��ͨ��CO2���������� | |
| B�� | ��Na2SiO3��Һ��ͨ��HCl���������� | |
| C�� | ��Ba��OH��2��KOH�����Һ��ͨ��CO2���������� | |
| D�� | ��Na[Al��OH��4]��Һ��ͨ��HCl���������� |
