��Ŀ����
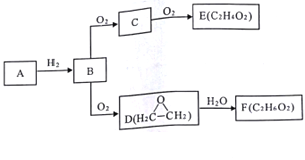
����Ŀ����֪���̿���̽�˿����Ҫ�ɷ־�ΪMnO2���������̵��Ʊ�����������������ͻ�ѧʵ�����й㷺Ӧ�á�
�������̵��Ʊ�:
�̷۵���Ҫ�ɷ�ΪNH4Cl��C��MnO2,���̷۽�����ͼ��ʾ������,�ɵõ��������̹��塣

(1)ijͬѧ��Ϊ�Լ�aΪ����ˮ,����Ϊ______(��ܡ����ܡ�)ʵ��ʵ��Ŀ�ġ�
(2)����1��������______,���õ��IJ����������ձ�����������______��
(3)�ڿ����г�����յ�Ŀ����_________��
�������̵����ʼ���:
��.������
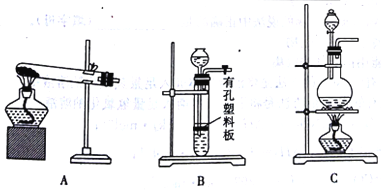
(4)ʵ������MnO2��Ũ���ᷴӦ�Ʊ�Cl2������ѡ�õ�װ����______(����ĸ)��
(5)��MnO2����NH3�����м��ȣ��ɵõ��غ�ɫ��Mn2O3��N2,�÷�Ӧ�Ļ�ѧ����ʽΪ_______��
��.��ԭ��
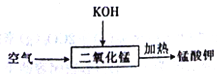
(6)���������������ķ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ______��
��.����
MnO2��ʵ������ȡO2�Ĵ�����ijͬѧ���ʵ��̽��˫��ˮ�ֽ��ʵ�鷽�����±���ʾ��
ʵ����� | w(H2O2)/% | ��״MnO2/g | �¶�/�� | �������� |
�� | 5 | 0 | 20 | |
�� | 5 | 1.0 | 20 |
(7)��ʵ��Ĵ���������___________��
(8)��ʵ��ٺ͢ڿɵó��Ľ�����______________________��
���𰸡� �� ���� (��ͨ)©�� ��ȥ������е�̼(C),�Եõ�������MnO2 C 6MnO2+2NH3=3Mn2O3+N2+3H2O 1:2 �ռ��������������Ҫ��ʱ��(����ͬʱ�������ռ������������) MnO2����˫��ˮ�ֽ�Ĵ���(������������)
��������(1) �̷۵���Ҫ�ɷ�ΪNH4Cl��C��MnO2,�Լ�aΪ����ˮ��NH4Cl����ˮ��C��MnO2������ˮ�����˷��룬����ʵ��ʵ��Ŀ�ģ�(2)����1�������ǹ���,���õ��IJ����������ձ�����������(��ͨ)©����(3)�ڿ����г�����յ�Ŀ���dz�ȥ������е�̼(C),�Եõ�������MnO2��(4)ʵ������MnO2��Ũ���ᷴӦ�Ʊ�Cl2��װ�ñ����ʺϡ���-Һ���������塱����ѡ�õ�װ����C��(5) MnO2��NH3��Ӧ����Mn2O3��N2��ˮ����Ӧ�Ļ�ѧ����ʽΪ6MnO2+2NH3=3Mn2O3+N2+3H2O��(6)�������̿�֪�����ķ�ӦΪ2MnO2+4KOH+O2![]() 2K2MnO4+2H2O�����ݷ�Ӧ��֪��������O2�뻹ԭ��MnO2�����ʵ���֮��Ϊ1��2��(7)���ݱ������ݿ��ƲⱾʵ��Ĵ����������ռ��������������Ҫ��ʱ��(����ͬʱ�������ռ������������)��(8)��ʵ��ٺ͢ڿɵó��Ľ�����MnO2����˫��ˮ�ֽ�Ĵ�����
2K2MnO4+2H2O�����ݷ�Ӧ��֪��������O2�뻹ԭ��MnO2�����ʵ���֮��Ϊ1��2��(7)���ݱ������ݿ��ƲⱾʵ��Ĵ����������ռ��������������Ҫ��ʱ��(����ͬʱ�������ռ������������)��(8)��ʵ��ٺ͢ڿɵó��Ľ�����MnO2����˫��ˮ�ֽ�Ĵ�����

 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�