题目内容
【题目】下列为元素周期表的一部分、表中阿拉伯数字(1、2……)是元素周期表中行或列的序号,请参照元素A~I在表中的位置,回答下列问题。
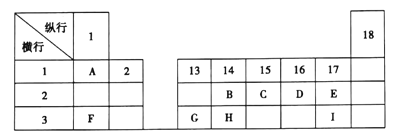
(1)B、C、H三元素中非金属性最强的是__________(写出元素符号)。
(2)表中某元素能形成两性氧化物,写出该氧化物的化学式___________。
(3)D与F构成原子个数比为1:1和1:2的两种离子化合物Z和M,写出Z与H2O反应的化学方程式_____________________________________。
【答案】N Al2O3 2Na2O2+2H2O==4NaOH+O2↑
【解析】
首先根据元素在周期表中的位置判断出元素,然后结合元素周期律和物质的性质分析解答。
根据元素在周期表中的位置可知A~I分别是H、C、N、O、F、Na、Al、Si、Cl。
(1)同周期自左向右非金属性逐渐增强,同主族从上到下非金属性逐渐减弱,则B、C、H三元素中非金属性最强的是N。
(2)表中元素能形成两性氧化物的是铝,其氧化物为Al2O3;
(3)O与Na构成原子个数比为1:1和1:2的两种离子化合物Z和M分别是过氧化钠和氧化钠,其中过氧化钠与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑。

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目