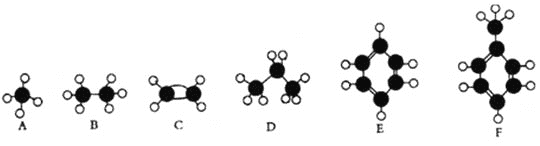
题目内容
【题目】为探究外界条件对可逆反应A(g)+B(g)![]() C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1molB,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为II、III、IV。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1molB,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为II、III、IV。
A | B | C | |
I | 0.050mol·L-1 | 0.050mol·L-1 | 0.050mol·L-1 |
II | 0.070mol·L-1 | 0.070mol·L-1 | 0.098mol·L-1 |
III | 0.060mol·L-1 | 0.060mol·L-1 | 0.040mol·L-1 |
IV | 0.080mol·L-1 | 0.080mol·L-1 | 0.12mol·L-1 |
针对上述系列实验,下列结论中错误的是
A. 由I中数据可计算出该温度下反应的平衡常数K=20
B. II可能是通过增大C的浓度实现的
C. 若III只是升高温度,则与I比较,可以判断出正反应一定是放热反应
D. 第IV组实验数据的得出,通过压缩容器的体积就可以实现
【答案】D
【解析】把平衡时各物质的浓度代入平衡常数表达式进行计算得:K=![]() mol-1·L,故A正确;计算平衡常数:K II =
mol-1·L,故A正确;计算平衡常数:K II =![]() ,说明Ⅰ与Ⅱ是相同温度下的平衡状态,增大C物质的浓度,平衡左移,A、B的浓度也会增大,但是平衡时C的浓度一定比开始时的大,故B正确;升高温度,C的浓度减小,而A、B浓度增大,说明平衡向逆反应方向移动,根据平衡移动原理,升高温度使平衡向吸热反应方向移动,所以逆反应为吸热反应,则正反应为放热反应,故C正确;D、计算平衡常数:KⅣ=
,说明Ⅰ与Ⅱ是相同温度下的平衡状态,增大C物质的浓度,平衡左移,A、B的浓度也会增大,但是平衡时C的浓度一定比开始时的大,故B正确;升高温度,C的浓度减小,而A、B浓度增大,说明平衡向逆反应方向移动,根据平衡移动原理,升高温度使平衡向吸热反应方向移动,所以逆反应为吸热反应,则正反应为放热反应,故C正确;D、计算平衡常数:KⅣ=![]() = 18.75mol-1·L≠KⅠ,说明Ⅳ和Ⅰ是不同温度下的平衡状态,只通过压缩容器的体积不能实现由平衡状态Ⅰ到平衡状态的Ⅳ转化,故D错误。
= 18.75mol-1·L≠KⅠ,说明Ⅳ和Ⅰ是不同温度下的平衡状态,只通过压缩容器的体积不能实现由平衡状态Ⅰ到平衡状态的Ⅳ转化,故D错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目