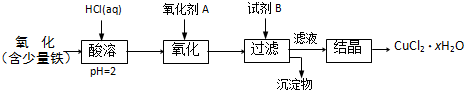
题目内容
(1)向盛有硫酸铜水溶液的试管里逐渐滴加氨水至过量,观察到的实验现象是:
(2)利用VSEPR理论推测下列分子或离子的空间构型:CO32-和SO32-的空间构型分别为
形成蓝色沉淀,继续滴加氨水蓝色沉淀溶解,得到深蓝色溶液
形成蓝色沉淀,继续滴加氨水蓝色沉淀溶解,得到深蓝色溶液
其反应的离子方程式为:Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+
Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+
.Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O
Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O
(2)利用VSEPR理论推测下列分子或离子的空间构型:CO32-和SO32-的空间构型分别为
平面三角形
平面三角形
和三角锥形
三角锥形
.其中心原子的杂化方式分别是sp2
sp2
和sp3
sp3
.分析:(1)先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液;
(2)价层电子对=σ 键电子对+中心原子上的孤电子对,CO32-中孤对电子
=0,SO32-中孤对电子为
=1,以此解答.
(2)价层电子对=σ 键电子对+中心原子上的孤电子对,CO32-中孤对电子
| 4+2-3×2 |
| 2 |
| 6+2-3×2 |
| 2 |
解答:解:(1)先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液,发生Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O,故答案为:形成蓝色沉淀,继续滴加氨水蓝色沉淀溶解,得到深蓝色溶液;Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O;
(2)价层电子对=σ 键电子对+中心原子上的孤电子对,CO32-中孤对电子
=0,SO32-中孤对电子为
=1,σ 键电子对均为3,则C采取sp2杂化,空间构型为平面三角形,S原子采取sp3杂化,空间构型为三角锥形,故答案为:平面三角形;三角锥形;sp2;sp3.
(2)价层电子对=σ 键电子对+中心原子上的孤电子对,CO32-中孤对电子
| 4+2-3×2 |
| 2 |
| 6+2-3×2 |
| 2 |
点评:本题考查离子反应方程式的书写及空间构型的分析,明确发生的化学反应是解答的关键,注意判断中心原子的价层电子对以及孤对电子数的判断.,题目难度不大.

练习册系列答案
相关题目
 (1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种.图中●、○分别指代哪种粒子
(1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种.图中●、○分别指代哪种粒子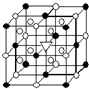 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子