题目内容
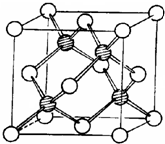
 (1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种.图中●、○分别指代哪种粒子
(1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种.图中●、○分别指代哪种粒子AlF6-
AlF6-
、Na+
Na+
;大立方体的体心处▽所代表的是AlF6-
AlF6-
(用化学式表示).(2)H2S和H2O2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
H2O2分子间存在氢键,与水分子可形成氢键
H2O2分子间存在氢键,与水分子可形成氢键
.(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体.与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有
Cr
Cr
(填元素符号).实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有共价键和配位键
共价键和配位键
.实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4?H2O晶体.实验中所加C2H5OH的作用是降低Cu(NH3)4SO4?H2O的溶解度
降低Cu(NH3)4SO4?H2O的溶解度
.分析:(1)根据均摊法确定含有各种微粒的数目,结合化学式确定微粒种类;
(2)氢键的存在导致氢化物的熔沸点升高、溶解性增大;
(3)与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素是铬;硫酸铜先和氨水反应生成氢氧化铜沉淀,氢氧化铜和氨水继续反应生成铜氨络合物,根据铜氨络合物的化学式确定含有的化学键类型;铜氨络合物在水中的溶解性大于在乙醇中的溶解性.
(2)氢键的存在导致氢化物的熔沸点升高、溶解性增大;
(3)与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素是铬;硫酸铜先和氨水反应生成氢氧化铜沉淀,氢氧化铜和氨水继续反应生成铜氨络合物,根据铜氨络合物的化学式确定含有的化学键类型;铜氨络合物在水中的溶解性大于在乙醇中的溶解性.
解答:解:A(1)黑色球个数=8×
+6×
=4,白色球个数=8+12×
=11,根据化学式知,Na+和AlF6- 的个数比是3:1,
则白色球和黑色球之比接近3:1,要是其为3:1,则▽所代表的应该是AlF6-,
故答案为:AlF6-;Na+;AlF6-;
(2)双氧水中氧元素电负性较大,双氧水分子间能形成氢键,与水分子间也可以形成氢键,而硫化氢分子间不能形成氢键,所以双氧水的熔沸点大于硫化氢,
故答案为:H2O2分子间存在氢键,与水分子可形成氢键;
(3)铜的价电子排布式为:3d104s1;与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有Cr;
铜离子和氨水先生成氢氧化铜沉淀,氢氧化铜能溶于氨水生成铜氨络合离子,铜氨络合离子中氢原子和氮原子之间 存在共价键,铜原子和氮原子之间存在配位键,所以铜氨络合离子中存在共价键和配位键,铜氨络合物中水中的溶解性大于在乙醇中的溶解性,为析出铜氨络合物,应向溶液中加入乙醇,
故答案为:Cr;共价键和配位键;降低Cu(NH3)4SO4?H2O的溶解度.
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
则白色球和黑色球之比接近3:1,要是其为3:1,则▽所代表的应该是AlF6-,
故答案为:AlF6-;Na+;AlF6-;
(2)双氧水中氧元素电负性较大,双氧水分子间能形成氢键,与水分子间也可以形成氢键,而硫化氢分子间不能形成氢键,所以双氧水的熔沸点大于硫化氢,
故答案为:H2O2分子间存在氢键,与水分子可形成氢键;
(3)铜的价电子排布式为:3d104s1;与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有Cr;
铜离子和氨水先生成氢氧化铜沉淀,氢氧化铜能溶于氨水生成铜氨络合离子,铜氨络合离子中氢原子和氮原子之间 存在共价键,铜原子和氮原子之间存在配位键,所以铜氨络合离子中存在共价键和配位键,铜氨络合物中水中的溶解性大于在乙醇中的溶解性,为析出铜氨络合物,应向溶液中加入乙醇,
故答案为:Cr;共价键和配位键;降低Cu(NH3)4SO4?H2O的溶解度.
点评:本题考查了物质结构和性质,化学式的确定、电子排布式的书写、氢键是高考热点,应重点掌握.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
 Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.
Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.
 (2)CS2是一种重要的有机溶剂,CS2分子的空间构型为 ;写出一种与CS2互为等电子体的物质的化学式 ;
(2)CS2是一种重要的有机溶剂,CS2分子的空间构型为 ;写出一种与CS2互为等电子体的物质的化学式 ;