题目内容
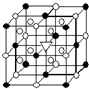 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子AlF6-
AlF6-
、Na+
Na+
;大立方体的体心处▽所代表的是AlF6-
AlF6-
.冰晶石在化工生产中的用途电解炼铝的助熔剂
电解炼铝的助熔剂
.(2)H2S和H2O2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
H2O2分子间存在氢键,与水分子可形成氢键
H2O2分子间存在氢键,与水分子可形成氢键
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体.写出铜原子价电子层的电子排布式
3d104s1
3d104s1
,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有Cr
Cr
(填元素符号).实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有共价键和配位键
共价键和配位键
.实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4?H2O晶体.实验中所加C2H5OH的作用是降低Cu(NH3)4SO4?H2O的溶解度
降低Cu(NH3)4SO4?H2O的溶解度
.B.用含少量铁的氧化铜制取氯化铜晶体(CuCl2?xH2O).有如下操作:
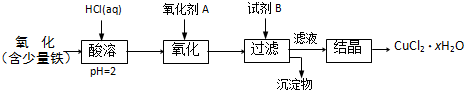
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解.
(1)加热酸溶过程中发生反应的离子方程式有:
Fe+2H+=Fe2++H2↑、CuO+2H+=Cu2++H2O
Fe+2H+=Fe2++H2↑、CuO+2H+=Cu2++H2O
(2)氧化剂A可选用
①
①
(填编号,下同)①Cl2 ②KMnO4 ③HNO3
(3)要得到较纯的产品,试剂B可选用
③
③
①NaOH ②FeO ③CuO
(4)试剂B的作用是
①③
①③
①提高溶液的pH ②降低溶液的pH ③使Fe3+完全沉淀 ④使Cu2+完全沉淀
(5)从滤液经过结晶得到氯化铜晶体的方法是
②④①
②④①
(按实验先后顺序填编号)①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(6)为了测定制得的氯化铜晶体(CuCl2?xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止、冷却、称量所得无水CuCl2的质量为n g.
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g.
试评价上述两种实验方案,其中正确的方案是
二
二
,据此计算得x=| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
分析:A(1)根据均摊法确定含有各种微粒的数目,结合化学式确定微粒种类,冰晶石可作助溶剂;
(2)氢键的存在导致氢化物的熔沸点升高、溶解性增大;
(3)铜元素基态原子核外有29个电子,根据核外电子排布式的排布规则书写其价电子排布式;与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素是铬;硫酸铜先和氨水反应生成氢氧化铜沉淀,氢氧化铜和氨水继续反应生成铜氨络合物,根据铜氨络合物的化学式确定含有的化学键类型;铜氨络合物在水中的溶解性大于在乙醇中的溶解性;
B.(1)铁和氧化铜都与盐酸反应生成盐,根据离子方程式书写规则书写;
(2)①加入的氧化剂和杂质离子反应,和铜离子不反应,且不能引进新的杂质离子;
(3)加入的物质能除去杂质,且不引进新的杂质;
(4)加入盐酸时,盐酸是过量的,导致溶液酸性较强,溶液酸性较强则铁离子不沉淀,为使铁离子沉淀温度则应提高溶液的pH;
(5)根据溶液获得晶体的方法分析;
(6)CuCl2?xH2O中x的值的确定依据是加热前后的质量差即为减少的水的质量,据此来确定x.
(2)氢键的存在导致氢化物的熔沸点升高、溶解性增大;
(3)铜元素基态原子核外有29个电子,根据核外电子排布式的排布规则书写其价电子排布式;与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素是铬;硫酸铜先和氨水反应生成氢氧化铜沉淀,氢氧化铜和氨水继续反应生成铜氨络合物,根据铜氨络合物的化学式确定含有的化学键类型;铜氨络合物在水中的溶解性大于在乙醇中的溶解性;
B.(1)铁和氧化铜都与盐酸反应生成盐,根据离子方程式书写规则书写;
(2)①加入的氧化剂和杂质离子反应,和铜离子不反应,且不能引进新的杂质离子;
(3)加入的物质能除去杂质,且不引进新的杂质;
(4)加入盐酸时,盐酸是过量的,导致溶液酸性较强,溶液酸性较强则铁离子不沉淀,为使铁离子沉淀温度则应提高溶液的pH;
(5)根据溶液获得晶体的方法分析;
(6)CuCl2?xH2O中x的值的确定依据是加热前后的质量差即为减少的水的质量,据此来确定x.
解答:解:A(1)黑色球个数=8×
+6×
=4,白色球个数=8+12×
=11,根据化学式知,Na+和AlF6- 的个数比是3:1,
则白色球和黑色球之比接近3:1,要是其为3:1,则▽所代表的应该是AlF6-,电解氧化铝时,氧化铝熔点较高,消耗电能较大,为使冰晶石在较低些温度熔融,向氧化铝中加入冰晶石,所以冰晶石可作助溶剂,
故答案为:AlF6-;Na+;AlF6-;电解炼铝的助熔剂;
(2)双氧水中氧元素电负性较大,双氧水分子间能形成氢键,与水分子间也可以形成氢键,而硫化氢分子间不能形成氢键,所以双氧水的熔沸点大于硫化氢,故答案为:H2O2分子间存在氢键,与水分子可形成氢键;
(3)铜的价电子排布式为:3d104s1;与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有Cr,只是铬元素的价电子排布式为3d54s1;
铜离子和氨水先生成氢氧化铜沉淀,氢氧化铜能溶于氨水生成铜氨络合离子,铜氨络合离子中氢原子和氮原子之间 存在共价键,铜原子和氮原子之间存在配位键,所以铜氨络合离子中存在共价键和配位键,铜氨络合物中水中的溶解性大于在乙醇中的溶解性,为析出铜氨络合物,应向溶液中加入乙醇,
故答案为:3d104s1;Cr;共价键和配位键;降低Cu(NH3)4SO4?H2O的溶解度;
B.(1)向固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+→Fe2++H2↑;CuO+2H+→Cu2++H2O,故答案为:Fe+2H+→Fe2++H2↑;CuO+2H+→Cu2++H2O;
(2)根据题意,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以A为Cl2,故选①;
(3)得到较纯的产品,试剂可选用CuO或Cu2(OH)2CO3,①②均会引入杂质离子,故答案为:③;
(4)溶液酸性较强则铁离子不沉淀,为使铁离子沉淀温度则应提高溶液的pH,故选①③;
(5)从滤液经过结晶得到氯化铜晶体,首先要加热蒸发浓缩,冷却后,再将之过滤即可,故答案为:②④①;
(6)CuCl2?xH2O中x的值的确定依据是加热前后的质量差即为减少的水的质量,所以选择方案二,根据Cu元素守恒,则
CuCl2?xH2O~Cu(OH)2~CuO,
1 1
x=
故答案为:二;
.
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
则白色球和黑色球之比接近3:1,要是其为3:1,则▽所代表的应该是AlF6-,电解氧化铝时,氧化铝熔点较高,消耗电能较大,为使冰晶石在较低些温度熔融,向氧化铝中加入冰晶石,所以冰晶石可作助溶剂,
故答案为:AlF6-;Na+;AlF6-;电解炼铝的助熔剂;
(2)双氧水中氧元素电负性较大,双氧水分子间能形成氢键,与水分子间也可以形成氢键,而硫化氢分子间不能形成氢键,所以双氧水的熔沸点大于硫化氢,故答案为:H2O2分子间存在氢键,与水分子可形成氢键;
(3)铜的价电子排布式为:3d104s1;与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有Cr,只是铬元素的价电子排布式为3d54s1;
铜离子和氨水先生成氢氧化铜沉淀,氢氧化铜能溶于氨水生成铜氨络合离子,铜氨络合离子中氢原子和氮原子之间 存在共价键,铜原子和氮原子之间存在配位键,所以铜氨络合离子中存在共价键和配位键,铜氨络合物中水中的溶解性大于在乙醇中的溶解性,为析出铜氨络合物,应向溶液中加入乙醇,
故答案为:3d104s1;Cr;共价键和配位键;降低Cu(NH3)4SO4?H2O的溶解度;
B.(1)向固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+→Fe2++H2↑;CuO+2H+→Cu2++H2O,故答案为:Fe+2H+→Fe2++H2↑;CuO+2H+→Cu2++H2O;
(2)根据题意,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以A为Cl2,故选①;
(3)得到较纯的产品,试剂可选用CuO或Cu2(OH)2CO3,①②均会引入杂质离子,故答案为:③;
(4)溶液酸性较强则铁离子不沉淀,为使铁离子沉淀温度则应提高溶液的pH,故选①③;
(5)从滤液经过结晶得到氯化铜晶体,首先要加热蒸发浓缩,冷却后,再将之过滤即可,故答案为:②④①;
(6)CuCl2?xH2O中x的值的确定依据是加热前后的质量差即为减少的水的质量,所以选择方案二,根据Cu元素守恒,则
CuCl2?xH2O~Cu(OH)2~CuO,
1 1
| m |
| 135+18x |
| n |
| 80 |
x=
| 80m-135n |
| 18n |
故答案为:二;
| 80m-135n |
| 18n |
点评:本题考查了物质结构和实验探究,化学式的确定、电子排布式的书写、氢键是高考热点,应重点掌握.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
 归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).
归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分). .
.
 煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.

