题目内容
8.硒(Se)被誉为“生命的奇效元素”,富硒食品倍受追捧,重庆多地打造富硒农产品基地.已知硒元素与氧元素同族,与钙元素同周期,下列关于硒的描述错误的是( )| A. | 原子序数是24 | |
| B. | 原子半径比硫原子的原子半径大 | |
| C. | 最高价氧化物是SeO3,是酸性氧化物 | |
| D. | 气态氢化物化学式是H2Se,还原性比HCl强 |
分析 A.硒元素与氧元素同族,与钙元素同周期,由周期性可知,与氧元素原子序数相差第三、第四周期容纳元素种数;
B.同主族自上而下原子半径增大;
C.第ⅥA族元素的最高价为+6价,Se为非金属元素,与同主族的S的化合物性质相似,氧化物属于酸性氧化物;
D.负化合价为-2,据此书写氢化物化学式,非金属性越强,则氢化物还原性越弱.
解答 解:A.硒元素与氧元素同主族,与钙元素同周期,Se在元素周期表中的第四周期第ⅥA族,与氧元素原子序数形成第三、第四周期容纳元素种数,其原子序数为8+8+18=34,故A错误;
B.同主族自上而下原子半径增大,故Se原子半径比硫原子的原子半径大,故B正确;
C.第ⅥA族元素的最高价为+6价,则最高价氧化物的化学式为SeO3,与同主族的S的化合物性质相似,属于酸性氧化物,故C正确;
D.硒的负化合价为-2,气态氢化物化学式是H2Se,非金属性:Cl>S>Se,则氢化物还原性:HCl<H2Se,故D正确;
故选A.
点评 本题考查结构性质位置关系应用,注意理解同族元素性质的相似性与递变性,难度不大.

练习册系列答案
相关题目
13.在标准状况时密度为2.5g/L的是( )
| A. | C4H8 | B. | C2H4 | C. | C2H2 | D. | CH4 |
16.在一定温度下,恒容密闭容器中,充入一定量的NO和O2,发生反应O2(g)+2NO(g)?2NO2(g),反应已达到平衡的标志是( )
| A. | 混合气体的颜色不再变化 | |
| B. | O2、NO、NO2三种物质的反应速率之比为1:2:2 | |
| C. | 反应混合物中各组分物质的浓度相等 | |
| D. | 混合气体的密度不再改变 |
3.已知断裂1mol C-H键,要吸收热量414.4kJ;断裂1mol C-C键,要吸收热量347.4kJ;生成1mol C═C键,会放出热量615.3kJ;生成1mol H-H键,会放出热量435.3kJ,某有机物分解的反应可表示为:

若在反应中消耗了1mol乙烷,则有关该反应的说法正确的是( )

若在反应中消耗了1mol乙烷,则有关该反应的说法正确的是( )
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
17.下列关于离子反应及离子共存的说法中正确的是( )
| A. | 能使甲基橙显红色的溶液中,Ba2+、Fe2+、Cl-、NO3-可以大量共存 | |
| B. | AlCl3溶液中加入过量的氨水:Al3++4OH-═[Al(OH)4]- | |
| C. | 常温下,由水电离的c(H+)=10-12mol/L的溶液:K+、Na+、SiO32-、HCO3-可以大量共存 | |
| D. | NaHCO3溶液中滴入少量Ca(OH)2溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
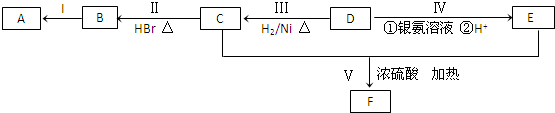
 .
. .
. ;②
;② 、
、 .
.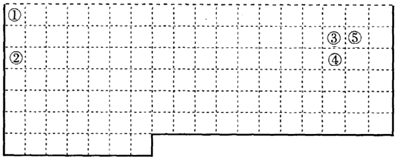
 (1)请指出锌电极和c电极的电极名称:(正、负、阴、阳)
(1)请指出锌电极和c电极的电极名称:(正、负、阴、阳)
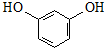

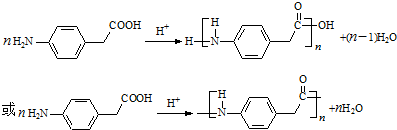 .
.