题目内容
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJmol﹣1
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJmol﹣1
则CO还原Fe2O3的热化学方程式为
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同温度条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1
测得CH3OH的物质的量随时间变化如下图所示,回答问题: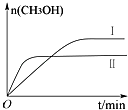
①该反应的平衡常数表达式K=;
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为:KⅠKⅡ(填“>”、“=”或“<”).
③下列措施中能增大CO2转化率的是 . (填序号)
A.升高温度B.充入He(g)使体系压强增大
C.将H2O(g)从体系中分离 D.再充入一定量CO2
④下列图象正确且能表明在t时刻反应一定处于平衡状态的是 . (填序号)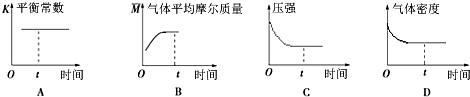
【答案】
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣28.5 kJ?mol﹣1
(2)![]() ;>;C;BC
;>;C;BC
【解析】解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol﹣1②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol﹣1
依据盖斯定律①﹣②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣28.5kJmol﹣1;
所以答案是:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣28.5kJmol﹣1;(2)①CO2(g)+3H2(g)CH3OH(g)+H2O(g)可知,K= ![]() ,所以答案是:
,所以答案是: ![]() ;②II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,即II的温度大于I,温度越高,平衡向逆反应方向移动,导致化学平衡常数越小,所以KⅠ>KⅡ , 所以答案是:>;③A.正反应是放热反应,所以升高温度,平衡逆向移动,二氧化碳转化率减小,故不选;
;②II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,即II的温度大于I,温度越高,平衡向逆反应方向移动,导致化学平衡常数越小,所以KⅠ>KⅡ , 所以答案是:>;③A.正反应是放热反应,所以升高温度,平衡逆向移动,二氧化碳转化率减小,故不选;
B.充入He(g)使体系压强增大,但各组分的浓度不变,平衡不移动,故不选;
C.将H2O(g)从体系中分离,减少生成物的浓度,平衡正向移动,二氧化碳的转化率变大,故选;
D.再充入一定量CO2 , 平衡正向移动,但本身的转化率减少,故不选;故选C;④A、平衡常数是温度的函数,温度不变,平衡常数不变,所以不能做平衡状态的标志,故错误;
B、气体的平均摩尔质量不变,说明各物质的量不变,说明反应达平衡状态,故正确;
C、压强不变说明各物质的量不变,反应达平衡状态,故正确;
D、气体的密度始终不变,所以不能做平衡状态的标志,故错误;故选BC.
【考点精析】关于本题考查的化学平衡状态本质及特征和化学平衡的计算,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】磷是地壳中含量较为丰富的非金属元素,它的单质和化合物在工农业生产中应用广泛。白磷可通过反应 2Ca3(PO4)2+10C→6CaO+P4+10CO 获得。完成下列填空:
(1)磷原子的最外层电子排布式是__________,氧原子核外有______种不同运动状态的电子。C、O两种元素非金属性较强的是_______________。
(2)白磷在空气中露置时间长了会因温度达到____而自燃,使白磷升温的热量主要来自_________。某温度时,在2.0L恒容密闭容器中充入0.5mol PCl5,发生反应PCl5(g)![]() PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
(3)该反应的平衡常数表达式 K=_____________;
(4)其他条件不变,起始时向上述容器中充入1.0 mol PCl5,达到平衡时,PCl5的转化率____(选填“增大”、 “减小”“不变”),平衡常数 K____(选填“增大”、 “减小”“不变”)。
(5)在不同时间(t)测得反应过程中 PCl5 的部分数据如下:
t(s) | 0 | 50 | 100 | 250 | 350 |
n(mol) | 0.5 | 0.42 | 0.41 | 0.40 | 0.40 |
则 100s 时, PCl3的物质的量浓度是__________________。